Tiivistelmä
Tässä katsauksessa pyritään käsittelemään Pfizer/BioNTech C4591001 -tutkimuksen tietojen tarkastelussa esiin tulleita merkittäviä poikkeamia ja ristiriitaisuuksia, joilla voi olla syvällisiä vaikutuksia yleisön luottamukseen ja sääntelynormeihin, jos niitä ei tutkita asianmukaisesti ja avoimesti.
Ilmiantajatodistukset
Ventavia Research Groupin entinen aluejohtaja Brook Jackson raportoi järjestelmällisistä ongelmista, kuten asianmukaisen tietoon perustuvan suostumuksen puuttumisesta, kelvottomien osallistujien rekisteröinnistä, tietojen väärentämisestä ja säännösten noudattamatta jättämisestä. Huolimatta siitä, että FDA:lle ilmoitettiin näistä huolenaiheista, niihin ei puututtu asianmukaisesti, eikä kriittisiä toimipaikkoja tarkastettu, mikä herättää kysymyksiä viranomaisvalvonnasta.
Augusto Roux’n tapaus
Tohtori Augusto Roux, joka osallistui tutkimukseen Argentiinassa, koki vakavia haittavaikutuksia rokotteen saamisen jälkeen, mukaan lukien sydänpussitulehdus, joka alun perin luokiteltiin sponsorin pyynnöstä virheellisesti mahdolliseksi COVID-19-tapaukseksi. Hänen haittavaikutusilmoituksensa oli puutteellisesti dokumentoitu, ja hänen oireitaan yritettiin luokitella uudelleen. Roux’n tapaus osoittaa, että yleisiä terveyssääntöjä on rikottu vakavasti, ja Argentiinassa on meneillään rikostutkinta hänen todistamistaan tapahtumista.
Satunnaistamisluvuissa esiintyvät poikkeamat
Kahden tutkijan 26. marraskuuta 2020 ja 29. maaliskuuta 2021 tuottamien tiedostojen analyysi paljasti selittämättömiä ristiriitaisuuksia satunnaistettujen koehenkilöiden määrässä. Esimerkiksi Argentiinassa sijaitsevassa tutkimuskohteessa 1231/4444 havaittiin vähenemistä 5776 koehenkilöstä 5615 koehenkilöön, mikä tarkoittaa 161 koehenkilön ”satunnaistamiskatoa”, mitä ei voida selittää koehenkilöiden siirtymisellä tutkimuskohteiden välillä tai alle 16-vuotiaiden koehenkilöiden rekrytoinnilla. Kaiken kaikkiaan 1203 koehenkilöä ”katosi satunnaistamisessa” 108:ssa 153:sta tutkimuspaikasta, mikä kertoo merkittävästä poikkeavuudesta.
Puuttuvat kohdetunnisteet
Tutkimushenkilöiden tunnisteissa havaittiin poikkeavuuksia, ja 301 puuttuvan tunnisteen määrä vaikutti suhteettomasti tiettyihin tutkimuspaikkoihin, erityisesti Argentiinassa. Tämän ongelman tutkiminen viittaa siihen, että tietojen käsittelyssä ei ole kyse satunnaisuudesta, mikä voisi viitata siihen, että koehenkilöiden tietoja on poistettu tarkoituksellisesti.
Kuolemantapausten ilmoittaminen myöhässä
Michels et al. ja Jeyanthi Kunadhasanin Australian Therapeutic Goods Administration (TGA) kanssa käymässä kirjeenvaihdossa korostetaan kuolemantapausten viivästyneen ilmoittamisen merkitystä EUA-luvuissa (Emergency Use Authorization). New England Journal of Medicine -lehdessä julkaistussa Polackin ym. tutkimuksessa raportoitiin kuudesta kuolemantapauksesta, kun taas Pfizerin sisäisissä tiedoissa oli jo kahdeksan kuolemantapausta, joista kahta BNT162b2-haaran kuolemantapausta ei julkistettu. Tällaiset viivästykset ja julkistamatta jättämiset, erityisesti sydäntapahtumiin johtaneiden kuolemantapausten osalta, herättävät vakavia huolenaiheita avoimuudesta ja mahdollisista yleisten toimintaohjeiden rikkomisista.
Protokollapoikkeamiin liittyvät sääntöjenvastaisuudet
Ilman sokkotarkastelua kirjatut protokollapoikkeamat, jotka ovat vastoin tavanomaisia kliinisten tutkimusten käytäntöjä, osoittivat merkittäviä epäsuhtaisuuksia hoitoryhmissä. Merkittäviä poikkeamia olivat muun muassa tutkimussuunnitelmassa määriteltyjen toimenpiteiden epäasianmukainen suorittaminen, virtsan raskaustestien tekemättä jättäminen ja muiden tutkimukseen kuulumattomien koronavirusrokotteiden saaminen, mikä viittaa siihen, että osallistujia itseään ei oltu sokkoutettu, ja tutkimuspaikan henkilökuntaa kohdeltiin lisäksi epäasianmukaisesti.
Ilmoittamattomat haittatapahtumat
Havaittiin tapauksia, joissa haittavaikutuksista ilmoitettiin liian vähän, kuten tapaus, jossa ”rintakipua” ei kirjattu haittavaikutuslokiin, vaan se kirjattiin vasta tapausraporttilomakkeisiin myöhemmän vakavan haittatapahtuman (SAE) vuoksi. Toinen esimerkki koski vakavan sydänpussitulehduksen virheellistä luokittelua COVID-19-sairaudeksi, mikä osoitti hyvien kliinisten käytäntöjen rikkomisen.
Haittavaikutusten uudelleenkelpuutus
Augusto Roux’n todistus paljastaa, että protokollan heikkouksia hyväksikäytettiin järjestelmällisesti, mikä johtaa siihen, että haittavaikutukset luokitellaan laajalti uudelleen COVID-19-oireiksi. AESPID-tietojen analyysi osoittaa, että ainakin 1209 haittavaikutusta 767 koehenkilön kohdalla luokiteltiin uudelleen vaikuttaen teho-, turvallisuus- ja immunogeenisuustuloksiin. Tämä uudelleenkelpuutusprosessi vaikuttaa tarkoitukselliselta manipuloinnilta haittavaikutusten salaamiseksi turvallisuusanalyysissä, mistä on osoituksena FDA:lle toimitettujen CRF-tiedotteiden suuri osuus asianomaisten koehenkilöiden joukossa.
Lisänäyttöä tietojen manipuloinnista
Haittavaikutusten kirjaamisessa havaittiin muita poikkeamia. Tietojenkäsittelylomakkeiden manuaalisissa tarkasteluissa havaittiin ristiriitaisuuksia, kuten kirjaamattomia haittavaikutuksia ja uudelleen luokiteltuja tai poistettuja tapahtumia. Tämä sisältää merkittävän alikirjaamisen ja CRF-asiakirjojen mahdollisen muuttamisen, mikä rikkoo yleisiä hoitokäytäntöjä ja mahdollisesti Yhdysvaltain ja kansainvälisiä säännöksiä.
Prosessin 2 virheellinen representaatio ja huolenaiheet
Pfizer/BioNTech käytti COVID-19-rokotetta kehittäessään kahta eri valmistusmenetelmää: ”Prosessi 1” suurimmassa osassa kliinisiä tutkimuksia ja ‘prosessi 2’ kaupallisessa tuotannossa, jota testattiin vain 252 vastaanottajalla. Prosessissa 1 käytettiin PCR-monistusta DNA-mallin tuottamiseen, kun taas prosessissa 2 käytettiin linearisoitua plasmidi-DNA:ta, jota kasvatettiin E. coli -bakteerissa, sekä muita tuotantoa lisääviä muutoksia. FDA:n, EMA:n, PMDA:n ja TGA:n sääntelyasiakirjat vahvistavat nämä erot ja niiden käytön kliinisissä ja kaupallisissa toimituksissa.
Suunnitellun vertailututkimuksen tarkoituksena oli arvioida turvallisuutta ja immunogeenisuutta 16-55-vuotiailla osallistujilla, mutta sitä ei lopulta toteutettu. Haittavaikutusraporttien analyysi osoittaa, että prosessien välillä on merkittäviä eroja, erityisesti prosessin 2 vastaanottajilla esiintyi enemmän haittavaikutuksia, kuten lymfadenopatiaa ja menorragiaa. Useat havainnot viittaavat siihen, että prosessien 1 ja 2 väliset valmistusmuutokset ovat vaikuttaneet rokotteen turvallisuusprofiiliin.
Johdanto
COVID-19-rokotteen kehittämisen ja hätätilaluvan (EUA) myöntämisen ennennäkemätön nopeus johti nopeutettuihin tarkistusprosesseihin. Tiukka post-hoc -analyysi on olennaisen tärkeä sen varmistamiseksi, että kaikki tiedot kerättiin, analysoitiin ja raportoitiin korkeimpien tieteellisten standardien mukaisesti. Tämä on ratkaisevan tärkeää tehokkaan markkinoilletuonnin jälkivalvonnan kannalta, sillä tarkat tutkimustiedot ovat olennaisen tärkeitä sellaisten pitkäaikaisvaikutusten tai harvinaisten haittatapahtumien tunnistamisessa, joita ei ehkä ole havaittu alkuperäisten tutkimusten aikana. Virheelliset perustiedot voivat haitata markkinoille tulon jälkeistä seurantaa ja vaarantaa potilasturvallisuuden. Kliinisen tutkimuksen eettiset normit edellyttävät tietojen raportoinnin avoimuutta ja tarkkuutta. Nykyiset puutteet ja avoimuuden puute C4591001-tutkimustiedoissa rikkovat eettisiä periaatteita, kuten tietoon perustuvaa suostumusta, ja ovat mahdollisesti vastoin velvollisuutta olla aiheuttamatta haittaa, jos riski/hyöty on esitetty väärin.
FDA suoritti tarkastelunsa 20. marraskuuta 2020 ja 11. joulukuuta 2020 välisenä aikana, ja tuloksena oli yllättävän lyhyt 57-sivuinen muistio [1]. Tarkastelun vakavuus on asetettu kyseenalaiseksi [2]. Avoimuuslupauksista huolimatta näyttöä useista analyytikkojen suorittamista tarkistuksista, kuten Peter Marksin väittämistä sähköpostiviesteistä, joita olisi vaihdettu niiden data-analyytikkojen välillä, jotka olisivat arvioineet kriittisesti tietoja, ei ole saatavilla. Koska olemme jo yli vuoden ajan etsineet vastauksia olennaisiin tietojen eheyttä koskeviin kysymyksiin, näillä kirjoittajilla on hyvät mahdollisuudet tietää, kuinka huolellisesti Marksin osasto käsittelee näitä huolenaiheita. Muut sääntelyelimet, kuten Ranskan Agence Nationale de Sécurité des Médicaments et des produits de Santé (ANSM) ja Australian Therapeutic Goods Administration, eivät ole toistaiseksi pystyneet vastaamaan asianmukaisesti esitettyihin huolenaiheisiin.
Kun otetaan huomioon välittömät todistajanlausunnot, joissa kuvataan hyvien kliinisten tutkimuskäytäntöjen vakavia rikkomisia, ja tosiseikat, jotka osoittavat, kuinka laajoja väärinkäytöksiä tässä tutkimuksessa esiintyi, on kiireellisesti suoritettava osallistuvien tutkimuspaikkojen ja tiedonhallinnasta vastaavien kliinisten tutkimusorganisaatioiden (CRO) kattava ja avoin tarkastus. Kirjoittajat toivovat, että yleisö hyödyntää tätä toistettavissa olevaa näyttöä, jotta asia saataisiin poliittisten päättäjien tietoisuuteen, ja oikeusviranomaisten on pysyttävä toimettomina.
Tässä kertomuksessa esitetyt tosiseikat perustuvat julkisiin asiakirjoihin, jotka on saatu tiedonvälityksen vapautta koskevien pyyntöjen (FOI) ja oikeudenkäyntien kautta. Merkittävä osa näistä asiakirjoista on peräisin Texasin tuomioistuimen määräyksestä [3] Public Health & Medical Professionals for Transparency (PHMPT) [4] -järjestön aloittamassa menettelyssä, joka mahdollisti sponsoreiden FDA:lle toimittamien tietojen julkaisemisen biologista lupahakemusta (BLA) varten.
Kirjoittajat
Tämä raportti on seuraavien kirjoittajien työn synteesi ja yhteistyön tulos:
- Josh Guetzkow, PhD, Vanhempi luennoitsija Jerusalemin heprealaisessa yliopistossa. (Twitter, Substack).
- Jeyanthi Kunadhasan MD (UKM), MMed (AnaesUM), FANZCA MMED (Monash) (Twitter, Substack)
- Brook Jackson, Kliinisen tutkimusorganisaation (CRO) Ventavian kliinisen tutkimuksen johtaja tutkimuksen aikana, ilmiantaja. (Twitter, Website)
- Christine Cotton, Biostatistikko, entinen CRO:n toimitusjohtaja 22 vuoden ajan. (Twitter, Website)
- Arkmedic (nimetön), ilmiantaja, PhD & LT (Substack)
- Augusto Roux, PhD, lakimies, Buenos Airesin yliopisto, kokeeseen osallistuja, ilmiantaja (Twitter)
- Huolestunut amyloidoosi (anonyymi), kliininen tutkija (Twitter, Substack)
- OpenVAET (anonyymi), Rikostekninen analyytikko ja data-analyytikko (Twitter, Substack)
Ennakoimamme elementit voidaan tarkistaa riippumattomasti ja käyttää vapaasti. Jos koetta varten tarvitaan allekirjoitettua valaehtoista todistusta, ota meihin yhteyttä kommenttien kautta.
Menetelmä
Viittaukset kaikkiin käytettyihin asiakirjoihin sekä [5] koodi, jota tarvitaan kaikkien edistyneiden lukujen ja kaavioiden jäljentämiseen, ovat mukana.
Latasimme [6], poimimme ja luokittelimme [7] PHMPT:n [8] kautta tällä hetkellä saatavilla olevat tiedot. Jos lähteitä tarvitaan, ne ilmoitetaan alaviitteissä.
Tutkimuksen yleiskatsaus ja demografiset tiedot
- Kliinisellä tutkimuksella oli kaksi päätavoitetta:
- tuotteen turvallisuus, joka esitetään positiivisen riski-hyötysuhdeprofiilin avulla (toisin sanoen ”säästää enemmän ihmisiä kuin se voi vahingoittaa”)
- tuotteen teho, jolla estää oireinen COVID-19-tauti, joka on vahvistettu PCR-testillä FDA:n vaatimusten mukaisesti.
Nämä vaiheet oli suoritettava, jotta saatiin hätäkäyttölupa (EUA). Pfizer ja BioNTech olivat ensimmäiset kilpailevista lääkealan konserneista, jotka ilmoittivat — lehdistötiedotteella 9. marraskuuta 2020 — että nämä tavoitteet oli saavutettu.
EUA:ta sovellettiin 20. marraskuuta 20209 sen jälkeen, kun tiedot oli analysoitu, ja tiedonkeruun päättymispäivä (cut-off) oli 14. marraskuuta 2020. Tämän jälkeen tavoitteena oli saada BLA — tavoite saavutettiin 23. elokuuta 2021 [10] — sen jälkeen, kun hakemus oli jätetty, jonka tietojen rajauspäivä oli 13. maaliskuuta 2021.
- Kliinisten lääketutkimusten tietokantaan on rekisteröity yhteensä 48 091 yksilöllistä koehenkilötunnusta, jotka 153 tutkimuspaikkaa seuloi 29. huhtikuuta 2020 ja 12. tammikuuta 2021 välisenä aikana [11].
- Tutkimuksessa kullekin tutkimuspaikalle annettiin nelinumeroinen tunniste, joka alkoi numerosta 1001. Yksi tutkimuskohteista, Dr. Mayor Cirujanon sotilaskeskussairaala Argentiinassa, jaettiin kahteen tunnisteeseen, 1231 ja 4444 (virtuaalinen viite [12]). Tutkimuspaikkojen nimet ja osoitteet sekä kunkin tutkimuspaikan päätutkijan henkilöllisyys esitetään yhdessä FDA:lle toimitetussa asiakirjassa [13].
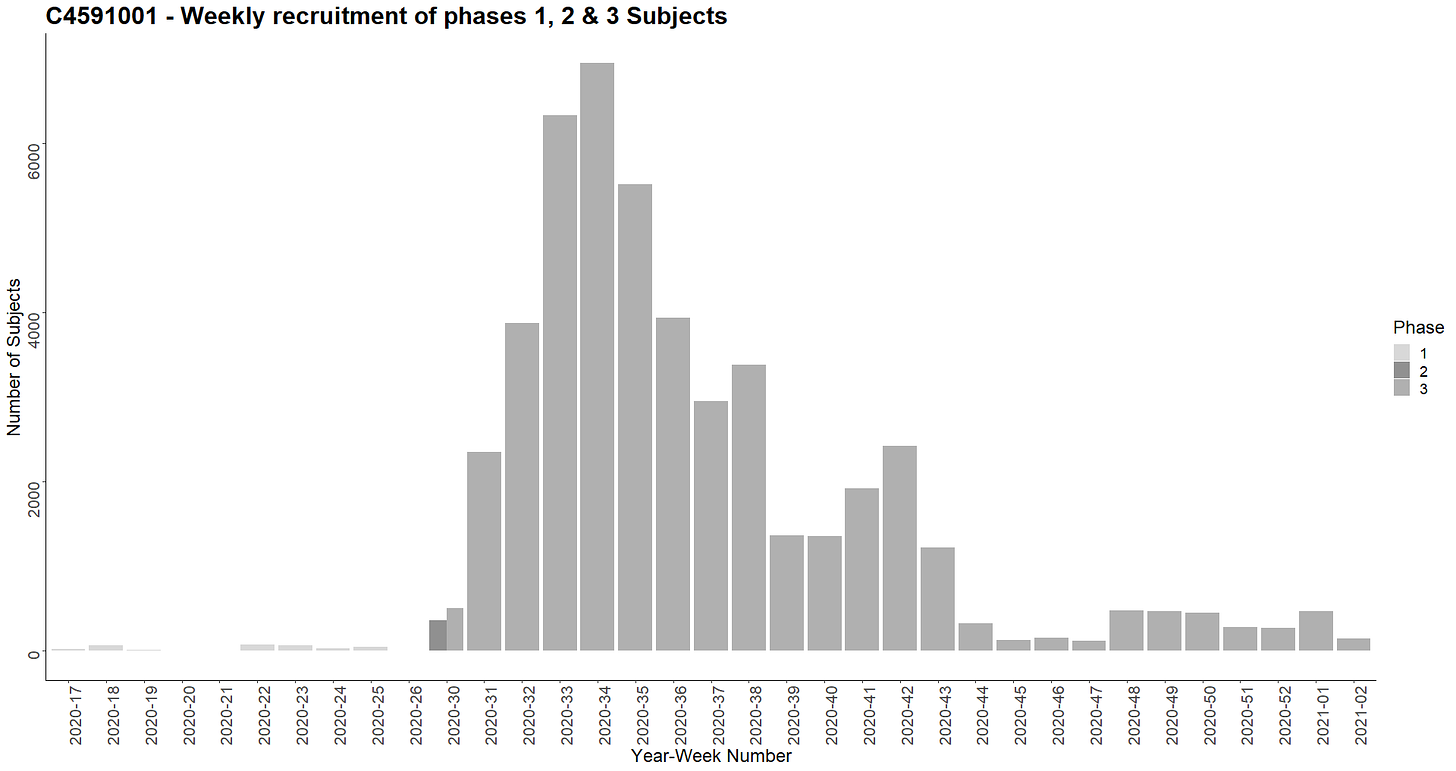
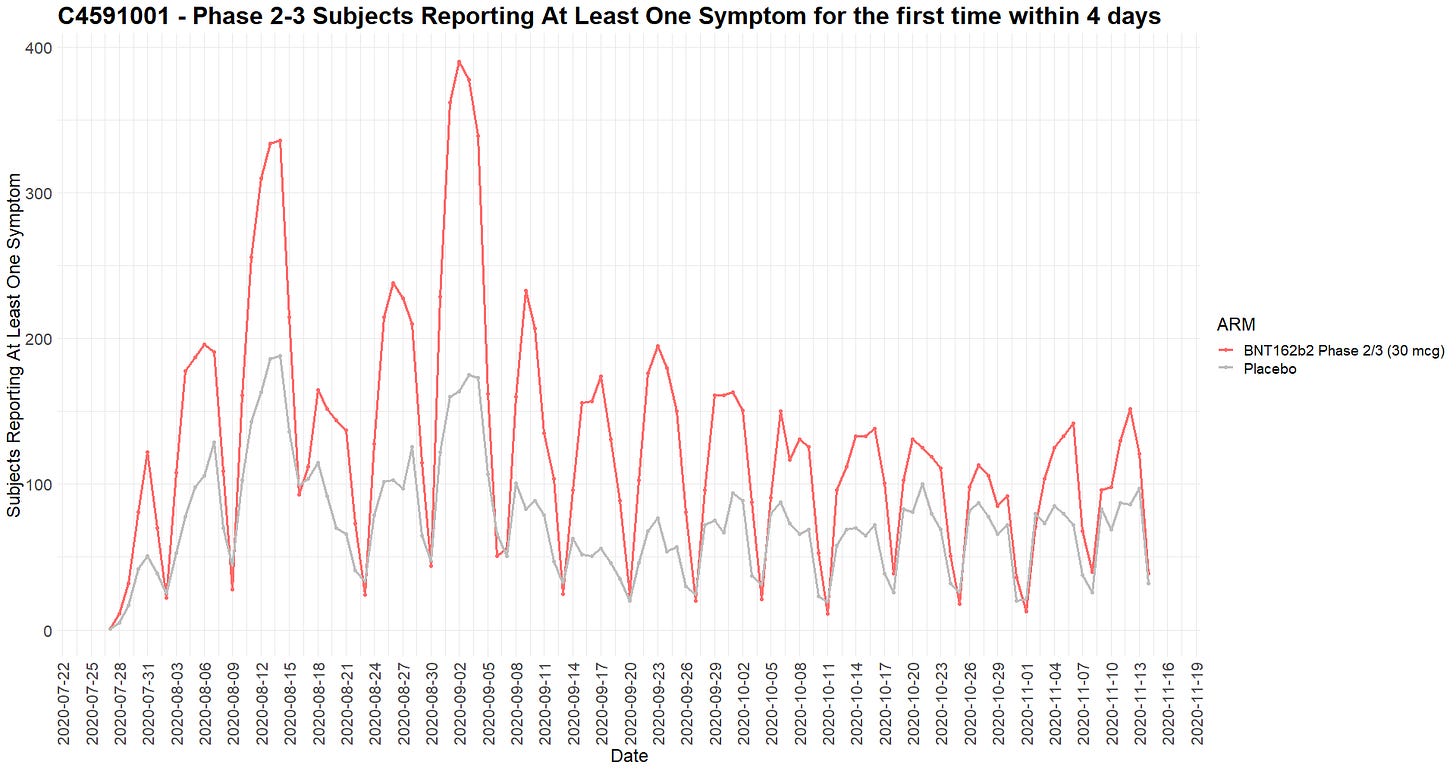
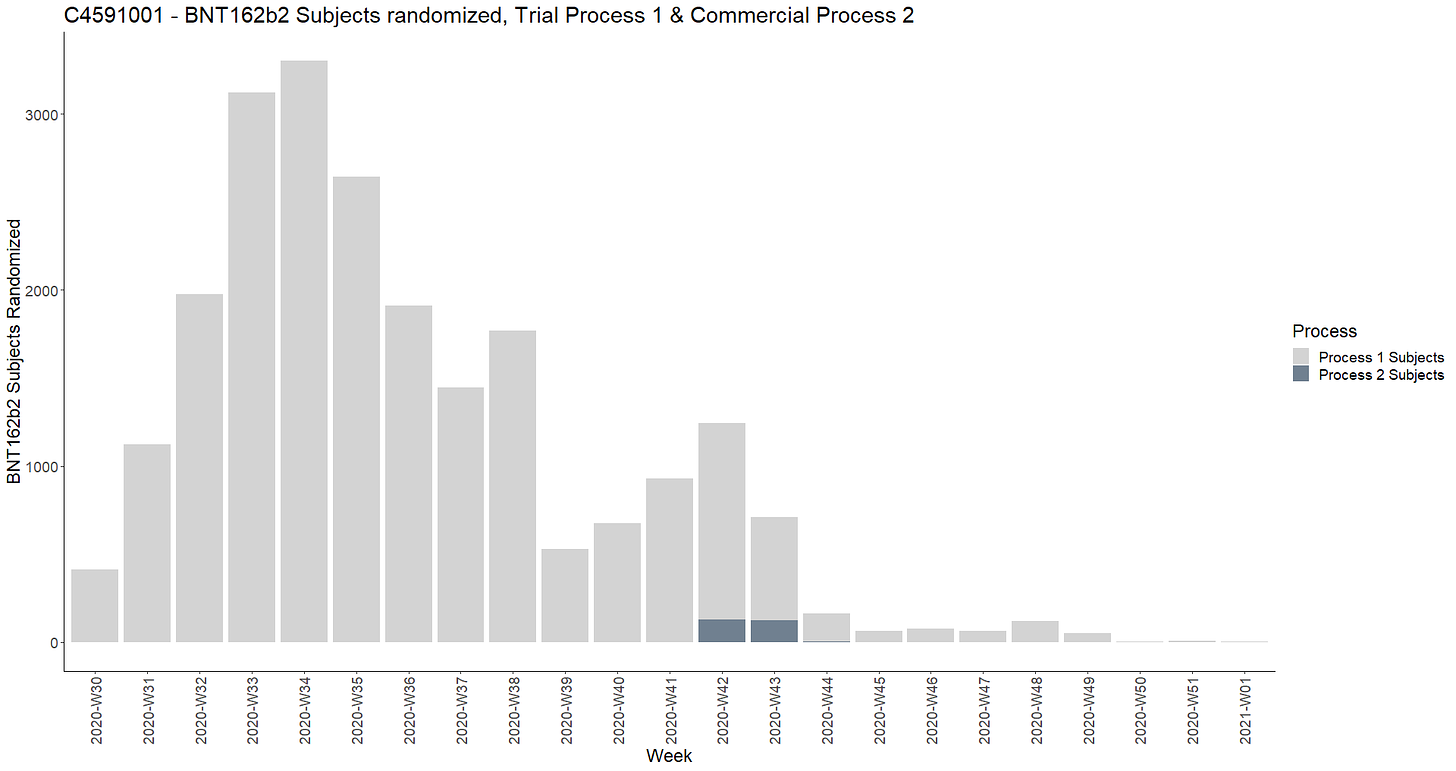
- Koehenkilöt rekrytoitiin 10 viikon aikana vaiheen 1 osalta ja 22 viikon aikana vaiheen 2-3 osalta. Seuraavassa kaaviossa esitetään viikoittainen rekrytointi [14].
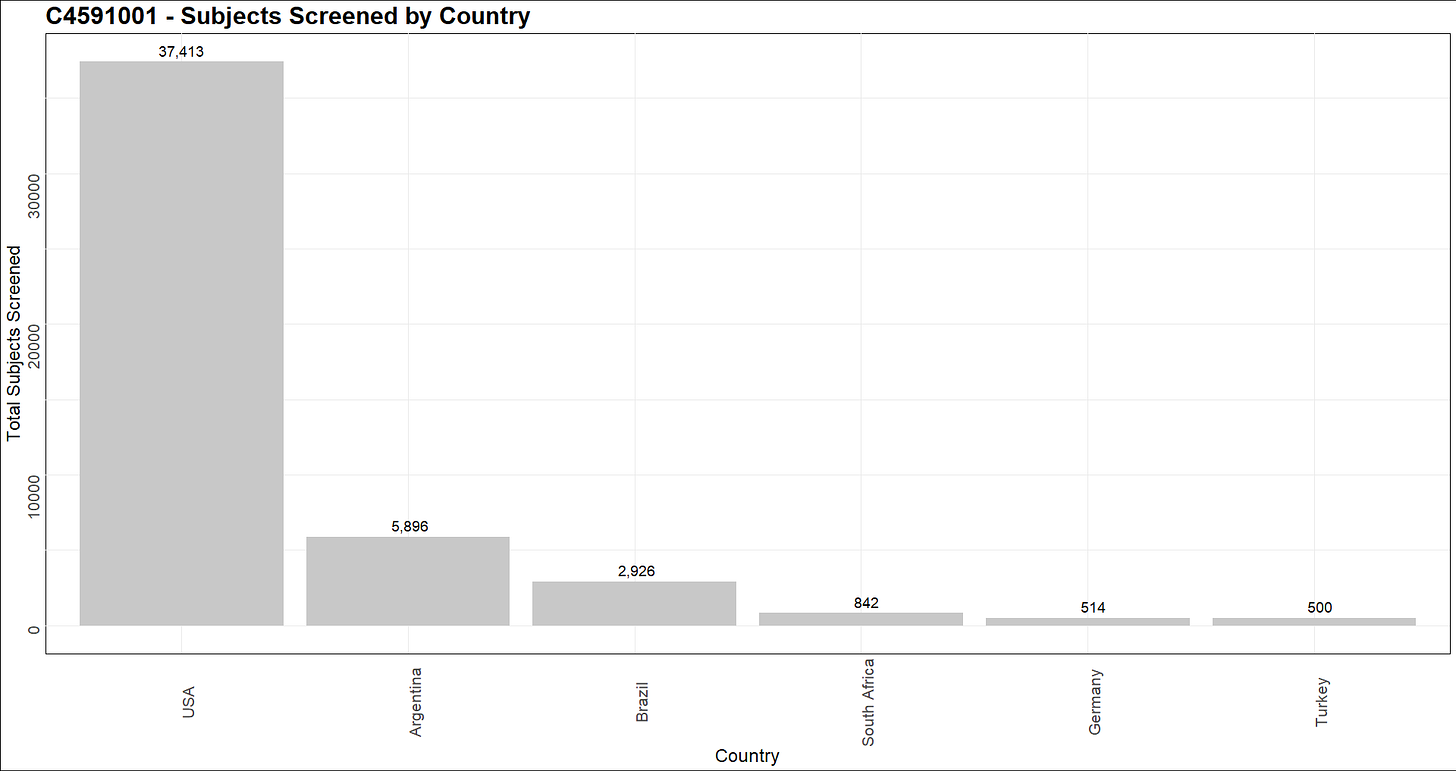
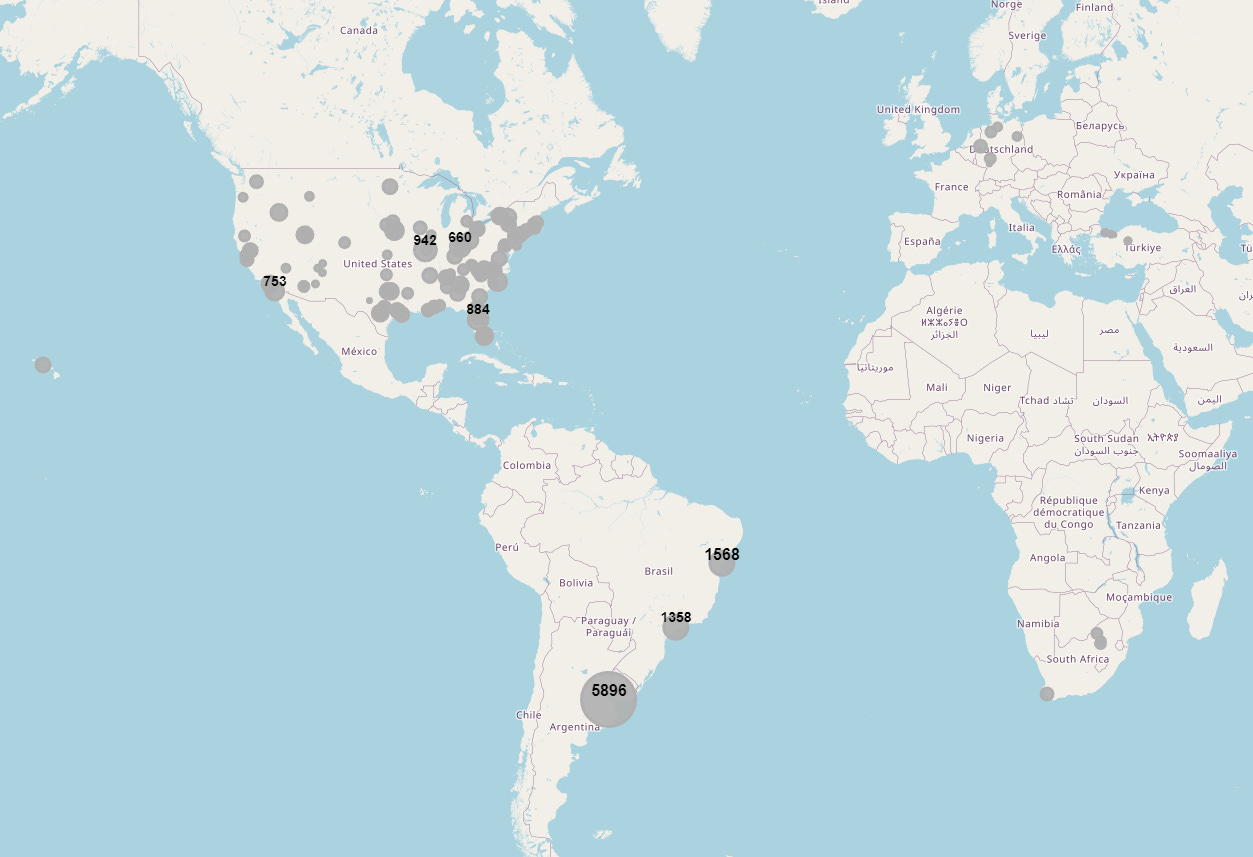
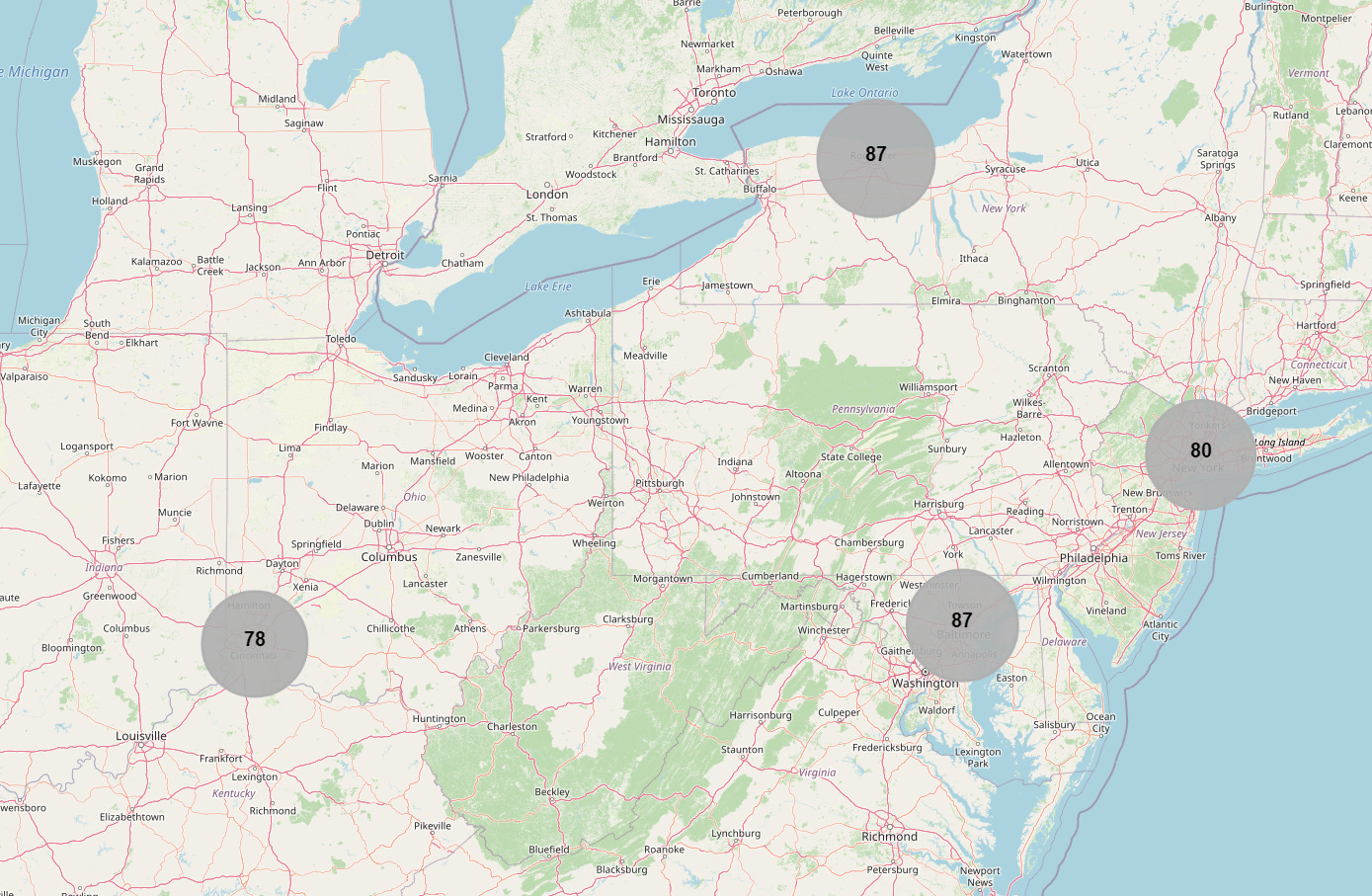
- Koehenkilöiden maantieteelliset koordinaatit yhdistettiin manuaalisesti JSON-tiedostoon [15], joka sisälsi leveys- ja pituusasteet. Kullekin maalle laadittiin yhteenveto suoritetuista rekrytoinneista [16] sekä alla oleva kartta koehenkilöittäin [17].
Tutkimus, joka esiteltiin seuraavasti: ”Plasebokontrolloitu, sokkoutettu tarkkailija, joka osoitti turvallisuuden ja tehon”
- Kliininen tutkimus esiteltiin yleisölle ”vaiheen 1/2/3 lumelääkekontrolloituna, satunnaistettuna, sokkoutettuna, annosmittaustutkimuksena SARS-CoV-2 RNA-rokotekandidaattien turvallisuuden, siedettävyyden, immunogeenisuuden ja mahdollisen tehon arvioimiseksi COVID-19-tautia vastaan terveillä henkilöillä”. [18]
- Vaiheiden 1 ja 2-3 koehenkilöille tehtiin erilaisia mittauksia (spesifiset neutraloivat vasta-aineet (N-Binding), PCR-testit (PCR), epi:n S1-alayksikölle ja reseptoria sitovalle domeenille (RBD) spesifinen immunoglobuliini G jne.) sen selvittämiseksi, olivatko he saaneet COVIDin ja miten he reagoivat tuotteeseen.
- Tehoa mitattiin tuotteen kyvyllä ehkäistä vahvistettuja COVID-19-tapauksia, ja se perustui kahteen ensisijaiseen päätetapahtumaan. Ensisijainen tehokkuustavoite oli estää oireiset laboratoriossa vahvistetut COVID-19-tapaukset vähintään 7 päivää toisen annoksen jälkeen osallistujilla, joilla ei ollut serologista tai virologista näyttöä aiemmasta SARS-CoV-2-infektiosta, ennen rokotusohjelmaa ja sen aikana. Toissijaisena tavoitteena oli arvioida rokotteen tehoa vakavia COVID-19-tapauksia vastaan.
- Turvallisuustavoitteisiin kuului paikallisten reaktioiden, systeemisten tapahtumien ja kuumetta alentavien lääkkeiden/kipulääkkeiden käytön arviointi päivästä 1 päivään 7 kunkin annoksen jälkeen osajoukolla osallistujista. Lisäksi tutkimuksessa pyrittiin seuraamaan ei-toivottuja, ei-vakavia haittatapahtumia ensimmäisestä annoksesta kuukauden kuluttua toisesta annoksesta kaikilla osallistujilla, vakavia haittatapahtumia ensimmäisestä annoksesta kuuden kuukauden kuluttua toisesta annoksesta kaikilla osallistujilla sekä kuolemantapauksia ja niihin liittyviä vakavia haittatapahtumia ensimmäisestä annoksesta tutkimuksen loppuun kaikilla osallistujilla. [19]
Vaiheen 1 epäjohdonmukaiset päivämäärät
- Kahden vaiheen 1 tuloksista raportoivan tutkimuksen [20, 21] mukaan vaihe 1 aloitettiin 4. toukokuuta 2020, ja rekrytointi (seulonta) jatkuisi 22. kesäkuuta 2020 asti.
- Nämä päivämäärät ovat virheellisiä, ja seulonta tapahtui 29. huhtikuuta 2020 ja 29. kesäkuuta 2020 välisenä aikana [22].
Vaihe 1 – Testatut tuotteet ja demografiset näkökohdat
- Vaiheen 1 seulontaan valittiin 332 koehenkilöä. 83 ei täyttänyt seulontaehtoja, ja 54:ää ei määritetty hoitoryhmään. Vaiheessa 1 testattiin annostusta ja ensisijaisia turvallisuuskysymyksiä 15 koehenkilön kohorteissa (12:lle annettiin hoitoa ja 3:lle plaseboa). Alun perin testattaviksi suunnitellut hoidot olivat:
- BNT162a1 (RNA-LNP-rokote, joka käyttää uRNA:ta ja koodaa RBD:tä): 3 μg, 10 μg, 30 μg
- BNT162b1 (BNT162 RNA-LNP-rokote, jossa käytetään modRNA:ta ja joka koodaa RBD:tä): 10 μg, 30 μg, 100 μg
- BNT162b2 (BNT162 RNA-LNP-rokote, jossa käytetään modRNA:ta ja joka koodaa P2 S:ää): 10 μg, 30 μg, 100 μg
- BNT162c2 (BNT162 RNA-LNP-rokote, jossa käytetään saRNA:ta ja joka koodaa RBD:tä): 3 μg, 10 μg, 30 μg.
- Muiden koehenkilöiden oli määrä saada toinen annos 22 päivää annoksen 1 jälkeen – itse asiassa 19-23 päivän [23] kuluttua annoksesta 1. Tämä aikaikkuna olisi EUA:n aikaan ja ilman asianmukaista muutosta tutkimussuunnitelmaan – joka vain mainittiin tilastollisessa analyysisuunnitelmassa – muuttunut 19-42 päiväksi [24].
- Vaihe 1 toteutettiin neljässä kohteessa. Ainoastaan Yhdysvalloissa sijaitsevat kohteet 1001, 1002, 1003 ja 1007 olivat mukana [25] — ne on esitetty alla olevassa kartassa [26].
- Testattujen tuotteiden määrä oli pienempi kuin alun perin oli suunniteltu:
- 24 koehenkilöä sai BNT162b1:tä (10 mcg)
- 12 koehenkilöä sai BNT162b1:tä (20 mcg)
- 24 koehenkilöä sai BNT162b1:tä (30 mcg)
- 24 koehenkilöä sai BNT162b2:ta (10 mcg)
- 24 koehenkilöä sai BNT162b2:ta (20 mcg)
- 24 koehenkilöä sai BNT162b2:ta (30 mcg)
- 12 koehenkilöä sai BNT162b1-annoksen (100 mcg), jota seurasi BNT162b1-annos (10 mcg)
- 39 koehenkilöä sai lumelääkettä
BNT162a1:tä ja BNT162c2:ta ei testattu. Vaiheeseen 1 suunniteltujen koehenkilöiden määrä muuttui toistuvasti [27], kun vaihe 1 oli käynnissä:
- 840:stä, 17. huhtikuuta 2020, 420:een, 11. kesäkuuta 2020
- 420:sta 630:een 1. heinäkuuta 2020
- 630:sta 195:een 24. heinäkuuta 2020.
Vaiheen 1 koehenkilöiden kulku
- Tietoon perustuvassa suostumuslomakkeessa [28] annetaan yksityiskohtaiset tiedot koehenkilöiden matkasta vaiheen 1 tutkimuksessa, johon sisältyi yhteensä 10 suunniteltua käyntiä.
- Ensimmäisellä tutkimuskäynnillä koehenkilölle tehtiin laaja testisarja, johon kuului myös vasta-ainetasojen mittaaminen sen varmistamiseksi, ettei hän ollut saanut COVID-19-tartuntaa ennen tutkimukseen osallistumista. Myös koehenkilön sairaushistoria käytiin läpi, ja hänen todettiin olevan sopiva osallistumaan tutkimukseen. Tämän seulontaprosessin jälkeen koehenkilö satunnaistettiin ja hänelle annettiin joko annos lumelääkettä tai aktiivista valmistetta.
- Seuraavana päivänä, toisella käynnillä, koehenkilön tila vahvistettiin, ja testejä tehtiin vähemmän. Tämä oli ainoa käynti, jossa tutkittavaa ei testattu vasta-aineiden varalta.
- Seuraavat käynnit tapahtuivat säännöllisin väliajoin. Kolmas käynti tapahtui viikon kuluttua ensimmäisestä annoksesta, ja neljäs käynti tapahtui toisen annoksen antamisen yhteydessä, joka annettiin 19-23 päivää ensimmäisen annoksen jälkeen. Viides ja kuudes käynti tehtiin viikon ja kahden viikon kuluttua toisesta annoksesta. Seitsemäs käynti tapahtui kuukauden kuluttua toisesta annoksesta, ja kahdeksas käynti oli suunniteltu tehtäväksi kuusi kuukautta myöhemmin. Yhdeksäs käynti oli suunniteltu tehtäväksi vuoden kuluttua toisesta annoksesta, ja kymmenes ja viimeinen käynti oli tarkoitus tehdä kahden vuoden kuluttua toisesta annoksesta.
- BNT162b2 100 μg:n koehenkilöt määrättiin erityiseen ”annosteluohjelmaan”, jossa toinen 10 μg:n annos annettiin 85-105 päivää ensimmäisen annoksen jälkeen. Julkisesti saatavilla olevissa pöytäkirjaversioissa ei ole missään dokumentoitu, miksi 100 μg:n koehenkilöitä kohdeltiin näin erityiskohteluun, vaikka tämän olisi pitänyt olla selvää.
- Käynnit, joiden vasta-ainemittaukset on säilytetty 13. maaliskuuta 2021 päättymispäivänä vaiheen 1 koehenkilöiden osalta, ovat käynnit 1-8 [29].
Poikkeavuudet vaiheen 1 vasta-ainemittauksissa
- Osa koehenkilöiden vaiheen 1 aikana tekemistä vasta-ainemittauksista esitetään Edward Walshin ym. aiemmin mainitussa tutkimuksessa ”Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates” [30].
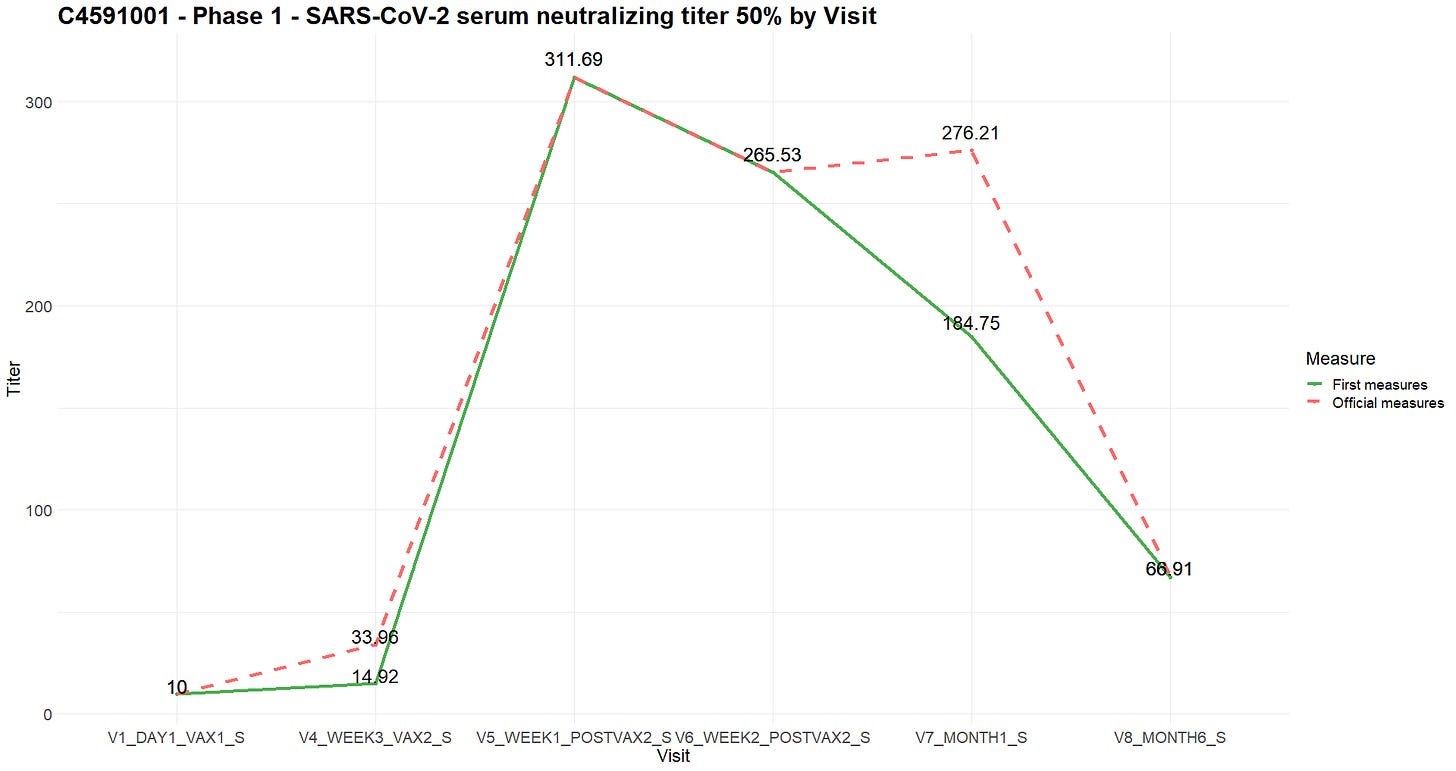
- ADVA:n tiedostossa, joka sisältää näiden testien tulokset, on 115 eroavaisuutta [31] samasta koehenkilöstä, saman käynnin aikana, samana päivänä ja saman testin aikana tehtyjen mittausten välillä. Ristiriitatapauksissa pidettiin useimmiten voimassa korkeampi arvo. Vaikka analyysitietojen tarkastajan oppaassa (ADRG [32]) mainitaan tämä poikkeama, siinä ei esitetä syytä siihen. Asiakirjassa, jossa luetellaan analyysimenetelmät [33], on kaksi mNeongreen-viruksen neutralisaatiomääritystä, jotka eroavat toisistaan siten, että toisessa on määritysraja (alaraja ja yläraja pienimmälle ja suurimmalle mitattavissa olevalle titterille). Asiakirjat VR-MQR-10214 [34] ja VR-MVR-10083 [35] ovat ”Qualification” ja ”Method Validation of the SARS-CoV-2 mNeonGreen Virus Microneutralization Assay”, ja niiden toimittamispäivät ovat 18. elokuuta 2020 ja 9. helmikuuta 2021. Vaikka näyttääkin siltä, että uusintatestien jälkeiset erot johtuvat ”validoiduista” neutralisaatiomäärityksen parametreista, kuulemamme asiantuntijat eivät pystyneet selittämään, miten samasta koehenkilöstä samana päivänä otetut näytteet voisivat tuottaa näin merkittäviä eroja mittauksissa – mikä herättää mahdollisuuden, että testit, joiden tulokset olivat ”pettymys”, oli ”uusittu” korvaamalla viallisista koehenkilöistä otetut näytteet näytteillä, joiden vasta-ainepitoisuudet olivat tunnetusti korkeat. Jos menetelmän muutos olisi pätevä, se herättäisi joka tapauksessa kysymyksiä aiempien mittausten pätevyydestä.
- Esimerkkinä alla oleva kaavio havainnollistaa ”SARS-CoV-2-seerumin neutraloiva titteri 50 (titteri) — virusneutralointimääritys” -mittausten eroja, kun verrataan ensimmäisten tehtyjen mittausten keskiarvoa ja jatkuvien mittausten keskiarvoa.
Vaiheen 2-3 koehenkilöiden kulku
- Tietoon perustuvassa suostumuslomakkeessa annetaan yksityiskohtaiset tiedot koehenkilöiden matkasta vaiheen 2-3 tutkimuksessa [36], johon kuului yhteensä kuusi suunniteltua käyntiä.
- Ensimmäisellä käyntikerralla koehenkilölle tehtiin pitkä luettelo testejä, vaikkakin vähemmän kuin vaiheen 1 koehenkilöiltä vaadittiin. Näihin kuului muun muassa koehenkilön vasta-ainetasojen mittaaminen sen varmistamiseksi, ettei hän ollut saanut COVID-19-tartuntaa ennen tutkimukseen osallistumista. Tutkittavan sairaushistoria käytiin läpi, ja hänen todettiin olevan sopiva osallistumaan tutkimukseen. Tämän jälkeen koehenkilö satunnaistettiin ja hänelle annettiin joko lumelääkeannos tai vaiheen 1 jälkeen ylläpidetty aktiivinen tuote, BNT162b2 30 mcg.
- Toisella käynnillä annettiin toinen annos. Tämä oli ainoa käynti, jolloin ei tehty vasta-ainemittauksia, jotka olisivat voineet antaa vahvistuksen infektioista, joita on voinut esiintyä ensimmäisen annoksen jälkeisinä päivinä oireettomina tai jotka ovat välttyneet PCR-tunnistukselta esimerkiksi siksi, että koehenkilö ei ole ilmoittanut oireistaan tai että häntä ei ole testattu oireiden ilmoittamisen aikana.
- Kolmas käynti tapahtui kuukauden kuluttua toisesta annoksesta, ja neljäs käynti oli suunniteltu pidettäväksi 6 kuukauden kuluttua toisesta annoksesta. Viides käynti tapahtui vuoden kuluttua toisesta annoksesta, ja kuudes ja viimeinen käynti oli suunniteltu tehtäväksi kahden vuoden kuluttua toisesta annoksesta.
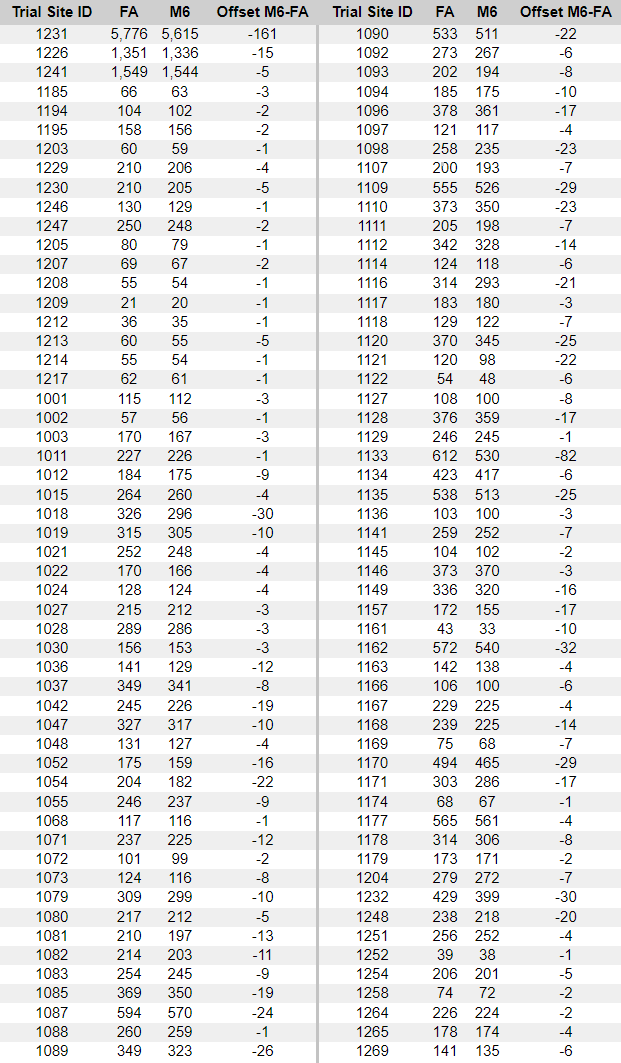
Ilmoitettujen satunnaistamislukujen ristiriitaisuudet
- Toimeksiantajat tuottivat kaksi ”tutkijatiedostoa”, joissa raportoitiin tutkimuskohteiden tutkijat ja kussakin kohteessa seulottujen ja satunnaistettujen koehenkilöiden kokonaismäärä. Ensimmäinen asiakirja laadittiin 26. marraskuuta 2020 [37] ja toinen 29. maaliskuuta 2021 [38]. Ensimmäisessä asiakirjassa mainitaan kyselypäiväksi 19. marraskuuta 2020 ja toisessa 19. maaliskuuta 2021. Vaikka seulottujen koehenkilöiden kokonaismäärässä toimipaikkaa kohti ei ole suurempaa muutosta kuin toimipaikkaa vaihtaneiden koehenkilöiden määrässä, satunnaistettujen koehenkilöiden kokonaismäärä laskee merkittävästi [39] ilman selitystä. Koehenkilöitä ei voida ”poistaa satunnaistamisesta” kliinisessä tutkimuksessa.
- Esimerkiksi alla olevassa kuvassa Argentiinassa sijaitseva koehenkilö 1231/4444 muuttui 5776 satunnaistetusta koehenkilöstä 26. marraskuuta 2020 5615:een (-161) 29. maaliskuuta 2021.
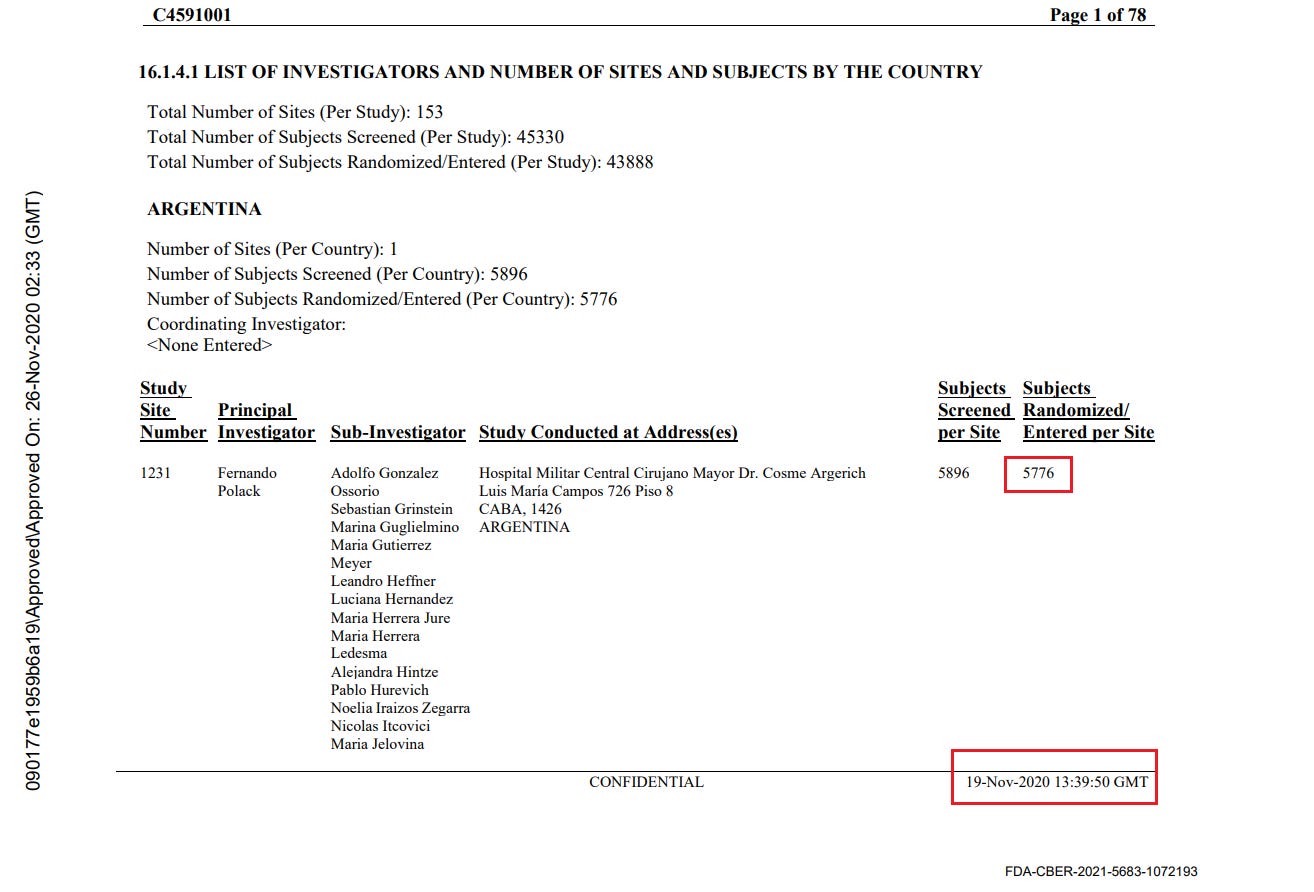
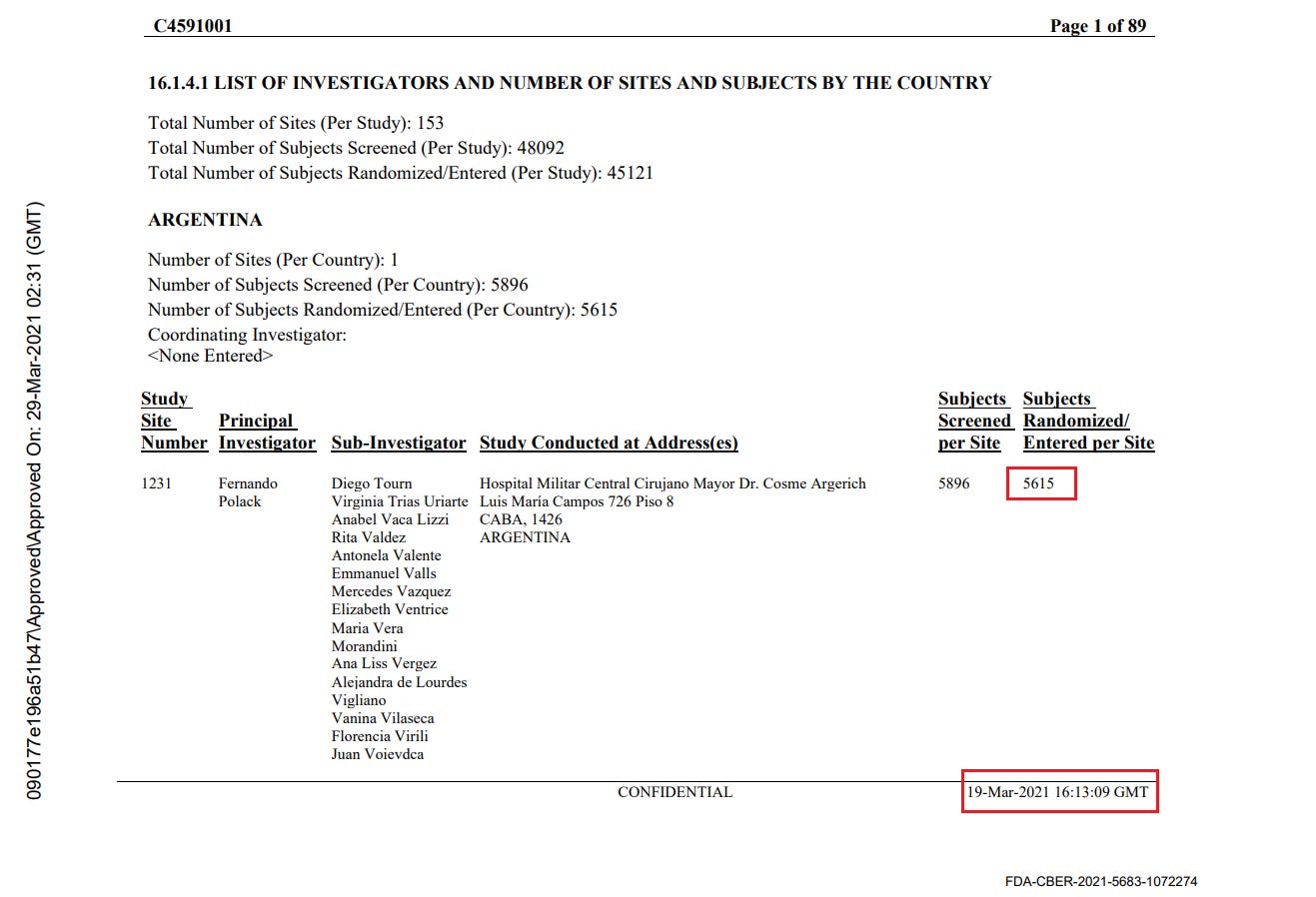
- Kaikkiaan 1203 koehenkilöä putosi pois tutkimuksesta, mikä vastaa 108:aa 153:sta tutkimuskohteesta. Tämä on merkittävä poikkeama, jota ei voida selittää koehenkilöiden siirtymisellä toimipaikkojen välillä tai alle 16-vuotiaiden koehenkilöiden rekrytoinnilla, jotka olisi sisällytetty yhteen raporttiin eikä toiseen. Anomalian havainnollistamiseksi voidaan todeta, että tutkimuspaikka 1018 menetti 30 koehenkilöä, kun taas yksikään koehenkilö ei siirtynyt sisään tai ulos ja että yhtään alle 16-vuotiasta nuorta ei ollut rekrytoitu 19. marraskuuta 2020, jolloin ensimmäinen tiedosto kysyttiin – eikä missään vaiheessa sen jälkeen. Alla oleva ote havainnollistaa kaikkia koepaikkoja, jotka menivät satunnaistamisluvuissa taaksepäin [40].
Vaihe 2-3 – Satunnaistamisluvut virallisesti julkaistu
- ADRG [41] dokumentoi 6 koehenkilöä, jotka rekisteröityivät useammalle kuin yhdelle koepaikalle, mikä synnyttää 12 koehenkilötunnusta ja joihin sovelletaan tiettyjä poissulkemisia (10561101, 11331382, 11101123, 11331405, 11491117, 12691090, 12691070, 11351357, 11341006, 10891112, 11231105, 10711213).
- BLA-hakemusmuistiossa [42] ja vastaavassa Thomas et al. NEJM-tutkimuksessa ”Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine through 6 Months ” [43] ilmoitetaan molemmissa yhteensä 44 165 satunnaistettua koehenkilöä 13. maaliskuuta 2021 mennessä. Tämä populaatio on toistettu [44] ja sen vastaavuus ilmoitettujen demografisten ominaisuuksien kanssa on varmistettu [45].
Sokkokokeeseen liittyvät poikkeamat
- Potilaiden, joiden käyttäytyminen poikkesi tutkimussuunnitelmassa esitetystä tai joiden kohdalla tutkimusryhmä teki virheen, tutkimussuunnitelmapoikkeamat kirjattiin ylös, minkä jälkeen erillinen ryhmä tarkasteli niitä uudelleen määrittääkseen, oliko poikkeama niin vakava, että se oikeuttaisi potilaan sulkemisen pois tietystä ”populaatiosta” (ryhmä, joka oli tarkoitettu jonkin tutkimustavoitteen (esim. tehon) analysointiin).
- Sääntelyviranomaisten hyväksymä tutkimussuunnitelma [46] poikkesi merkittävästi tavanomaisesta kliinisen tutkimuksen käytännöstä: paikan päällä työskentelevää henkilökuntaa, joka oli vastuussa tutkimussuunnitelmasta poikkeamisen tutkimisesta ja osallistujien mahdollisen poissulkemisen määrittämisestä, ei tarkastettu sokkona.
- Satunnaistetun vaiheen 3 populaation [47] tuottamien poikkeamien analyysi tuo esiin merkittäviä epäsuhtaisuuksia hoitoryhmissä. Seuraavassa taulukossa on yhteenveto kaikista poikkeamista, jotka havaittiin yli 100 tutkimushenkilöllä ja jotka osoittavat tilastollisesti merkittävää epätasapainoa verrattuna satunnaistetun populaation muuhun osaan (22 085 BNT162b2 & 22 080 Placebo), käyttäen khiin neliö -testiä.
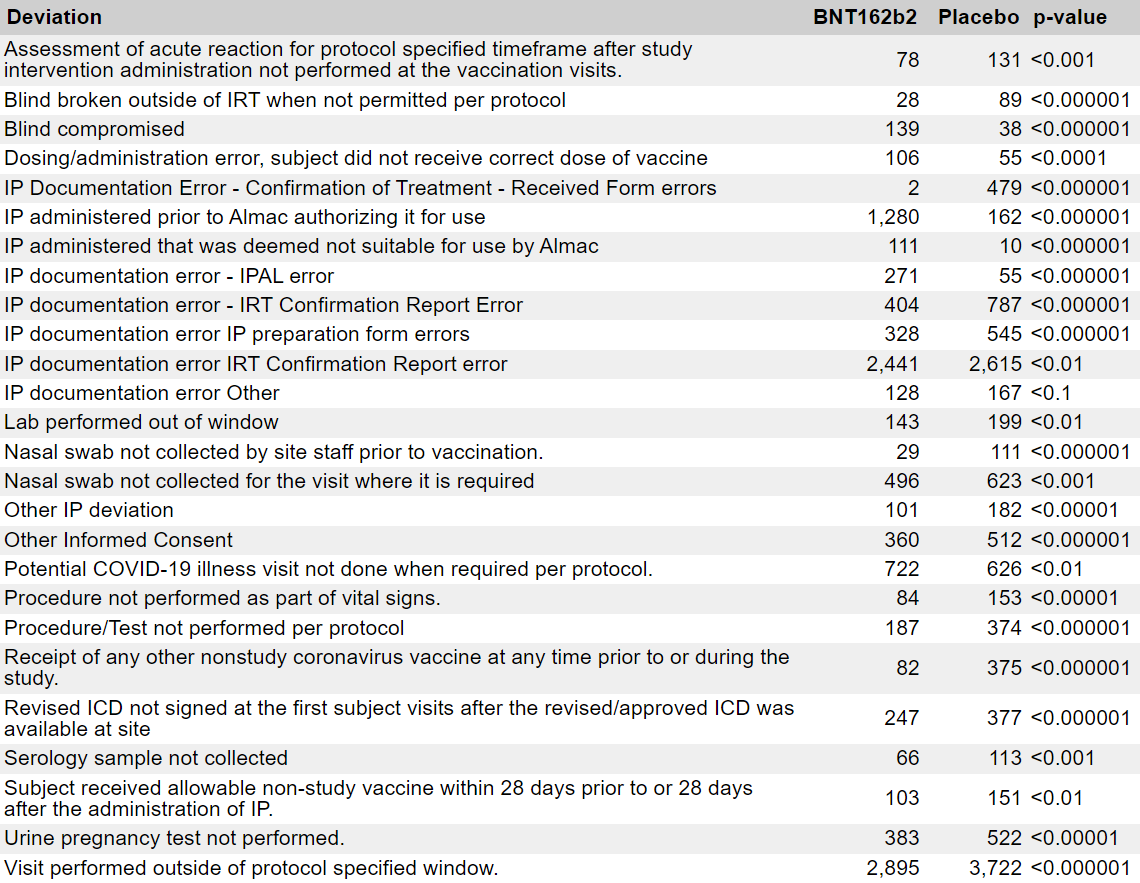
- Eräät hyvin merkittävät poikkeamat — kuten ”Minkä tahansa muun kuin tutkimukseen kuuluvan koronavirusrokotteen saaminen milloin tahansa ennen tutkimusta tai sen aikana” — osoittavat, että monet koehenkilöt olivat tietoisia siitä, että he olivat saaneet lumelääkettä — ja olivat samanaikaisesti osallistuneet kilpailijan tutkimukseen (todennäköisesti Moderna) tai saaneet toisen tuotteen hätätilanteessa myönnetyn käyttöluvan jälkeen. Toisaalta tietyt epäsuhtaisuudet osoittavat, että tiettyjen toimipaikkojen tutkimusryhmät eivät kohdelleet potilaita siten kuin sokkoutetussa havainnointitutkimuksessa odotetaan, jossa kliinisen tutkimusryhmän olisi kohdeltava molempia ryhmiä tasapuolisesti:
- Akuutin reaktion arviointi protokollassa määritellyn ajanjakson aikana tutkimustoimenpiteen antamisen jälkeen, jota ei suoriteta rokotuskäyntien yhteydessä
- Hoitopaikan henkilökunta ei ole ottanut nenänäytettä ennen rokotusta
- Nenänäytettä ei ole otettu sitä käyntiä varten, jota varten sitä tarvitaan
- Toimenpide/testi, jota ei ole tehty protokollan mukaisesti
- Raskaustestiä ei ole tehty virtsasta.
- Poikkeamien ”Minkä tahansa muun kuin tutkimuksessa käytetyn koronavirusrokotteen saanti” osalta on syytä huomata, että suuri osa niistä tapahtui joulukuun 2020 jälkeen, kun muita rokotteita tuli saataville.
- Kymmenen koehenkilöä, joita koskee 20 tai enemmän näistä poikkeamista ja jotka osoittavat merkittävää epätasapainoa Fisherin tarkalla testillä testattaessa, on eristetty ja koottu seuraavaan taulukkoon.
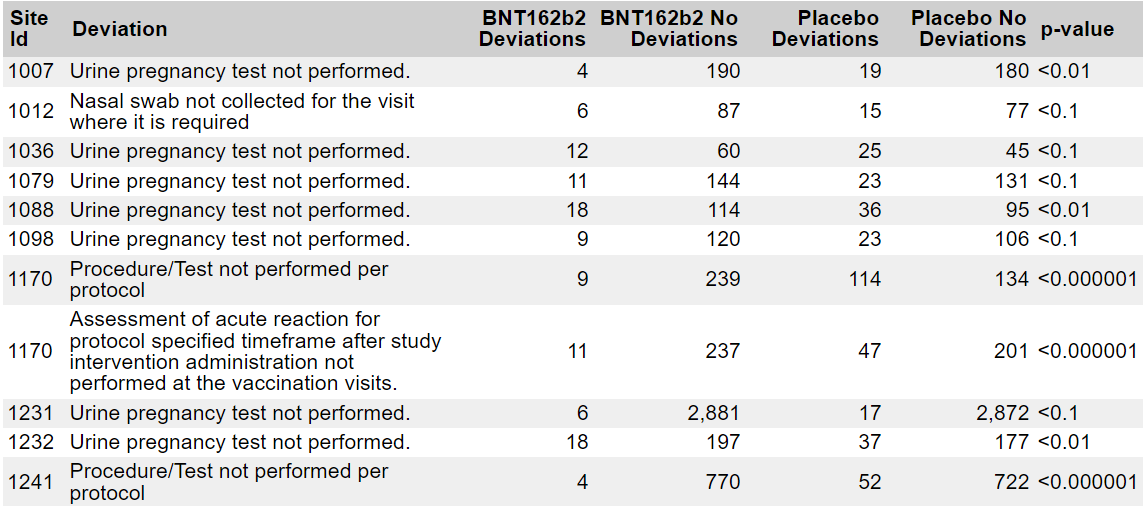
- Toisin kuin 32 kohdassa tarkoitetut ”koehenkilöihin liittyvät” poikkeamat, 31 kohdassa mainitut ”henkilökuntaan liittyvät” poikkeamat tutkitaan suurimmaksi osaksi ennen koehenkilöiden virallista sokon purkamista.
COVID-käynnit ja oireiden poikkeavuudet
- Kun koehenkilöt kokivat COVID-oireita FDA:n ennalta määrittelemästä luettelosta, heidän oli mentävä tutkimuspaikalle ottamaan näytteitä — tai, jos se ei onnistunut, testattava itsensä kotona toimitetuilla testeillä ja lähetettävä näyte tutkimuspaikalle neljän päivän [48] kuluessa ennen oireiden alkamista tai sen jälkeen. ”Viralliset” COVID-oireet olivat seuraavat 13 oiretta [49]:
- Vilunväristykset
- Ripuli
- Kuume
- Haju- tai makuaistin katoaminen
- Uusi tai pahempi yskä
- Uusi tai pahempi lihaskipu
- Uusi tai pahempi hengenahdistus
- Kurkkukipu
- Oksentaminen
Näiden oireiden lisäksi oli myös ”epävirallisia” oireita:
- Väsymys
- Päänsärky
- Nenän tukkoisuus
- Vuotava nenä
- ”Covid-19 Signs and Symptoms” .XPT-tiedostossa (ADSYMPT [50]) luetellaan kuitenkin yhteensä 15 oiretta — ne, joita ei ole merkitty protokollaan, on merkitty (*):
- Vilunväristykset
- Ripuli
- Väsymys
- Kuume
- Päänsärky
- Pahoinvointi (*)
- Haju- tai makuaistin katoaminen
- Uusi tai pahempi yskä
- Uusi tai pahempi lihaskipu
- Uusi tai pahempi nenän tukkoisuus
- Uusi tai pahempi hengenahdistus
- Uusi tai pahempi kurkkukipu
- Uusi tai pahempi hengityksen vinkuna (*)
- Vuotava nenä
- Oksentaminen
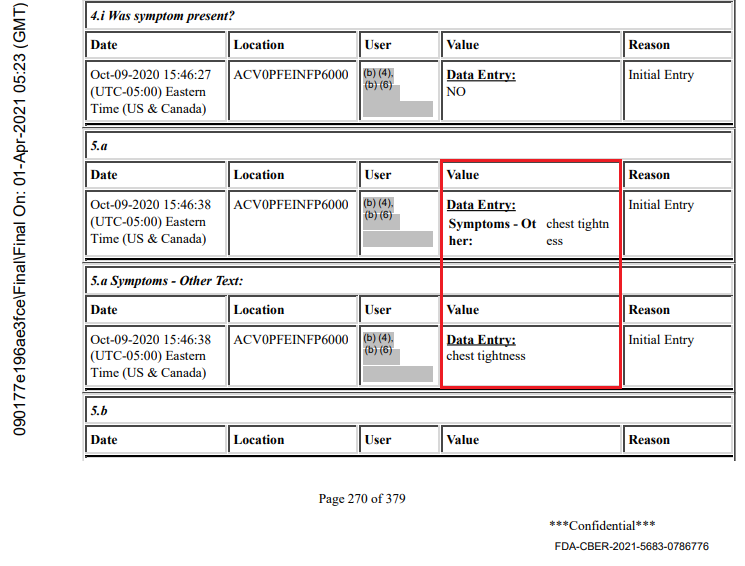
- Tutkimuspaikoilla oli myös mahdollisuus ilmoittaa ”muita” oireita, joita ei kuitenkaan kirjattu tietokantaan. Esimerkiksi koehenkilö 10161289 [51], 17-vuotias mies, BMI 22,4, joka sai BNT162b2 30 mcg -annoksen 1 18. syyskuuta 2020 ja annoksen 2 7. lokakuuta 2020. Hänellä oli COVID 7. ja 11. lokakuuta, arviointi 9. lokakuuta ja oireet: kuume, yskä, lihaskipu, kurkkukipu, nuha. Tapausselostuslomakkeiden sivulla 270 ”rintakipu” on kuitenkin mainittu ”muuna” oireena. Sitä ei ole raportoitu haittavaikutuslokissa, ja se on näkyvissä vain siksi, että nuorella miehellä oli myöhemmin 31. lokakuuta 2020 vakava haittavaikutus : moottoriajoneuvo-onnettomuus, jossa hän kärsi kasvojen murtumia ja aivotärähdyksen, mikä johti hänen CRF:nsä julkaisemiseen. Tämä on vastoin yleisiä terveyssääntöjä – myös EMAn hyvää kliinistä käytäntöä koskevia ohjeita [52].
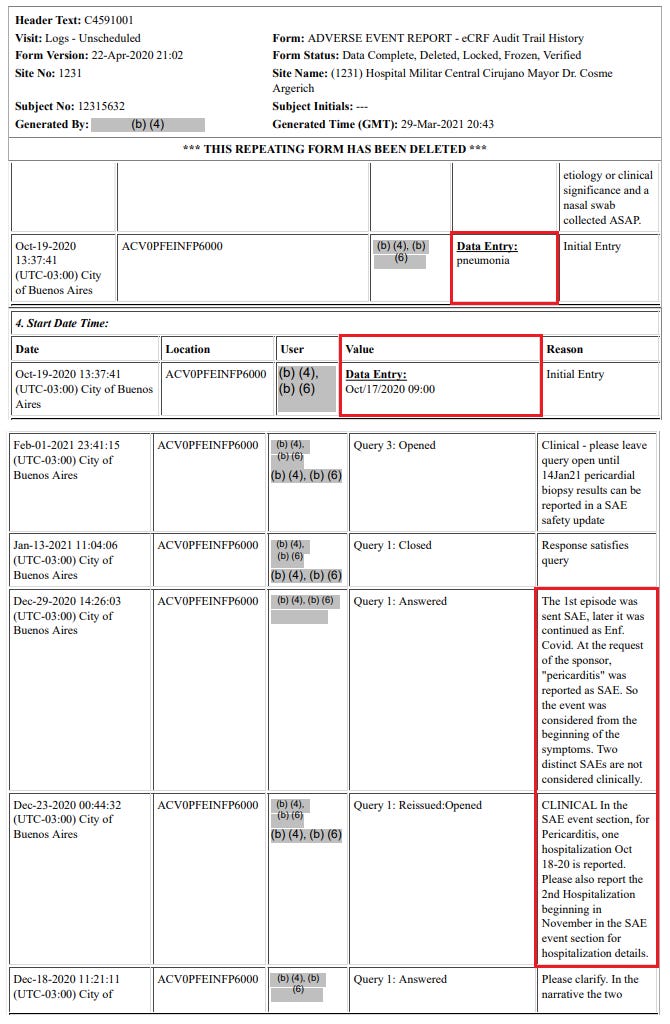
- Toinen esimerkki siitä, että hoitopaikat ovat rikkoneet GCP:tä, on koehenkilö 12315632 [53], toinen BNT162b2 30 mcg -vastaanottaja. Hänen COVID-sairausmerkintänsä kattaa ajanjakson 17. lokakuuta 2020 – 7. joulukuuta 2020, ja siihen sisältyy kaksi sairaalahoitoa. Vaikka hoitopaikka kuvailee hänen tilansa aluksi keuhkokuumeeksi, koehenkilö kärsi SAE:stä (sydänpussitulehdus), joka raportoitiin vasta sponsorin pyynnöstä. hoitopaikka raportoi aluksi ”keuhkokuumeen” haittatapahtumana, mutta poisti sen myöhemmin ja siirsi sen COVID-sairauskäyntiin. Jos Pfizer ei olisi vaatinut sydänpussitulehduksen merkitsemistä sydänpussitulehduksen haittavaikutusrekisteriin, se olisi jäänyt raportoimatta tutkimustiedoissa ja olisi ollut vain Pfizerin faksilla lähetetyssä turvallisuustietokannassa.
Sokkouttamisen ja hyvien kliinisten käytäntöjen kunnioittamatta jättäminen, Brook Jacksonin lausunto
- Ilmiantaja Brook Jackson, joka toimi alueellisena johtajana Ventavia Research Groupissa (Ventavia), joka oli tutkimukseen osallistujien rekisteröinnistä vastaava toimipaikan hallinnointiorganisaatio, toimitti British Medical Journalille (BMJ) yrityksen sisäisiä asiakirjoja, valokuvia, äänitallenteita, sähköpostiviestejä ja muuta todistusaineistoa, joka herätti huomattavia huolenaiheita tietojen eheydestä ja tutkimukseen osallistujien turvallisuudesta [54].
- Hän raportoi muun muassa seuraavista eri tutkimuspaikoissa dokumentoiduista järjestelmällisistä ongelmista:
- Asianmukaisen tietoon perustuvan suostumuksen puuttuminen: Sisäisessä laadunvarmistustarkastuksessa, jossa tarkasteltiin satoja yksittäisiä osallistujatietoja, havaittiin, että jokaiselta osallistujalta ei saatu tietoista suostumusta ennen tutkimusvalmisteen pistämistä. Lisäksi todettiin, että monissa näistä lomakkeista oli selviä allekirjoitusvirheitä, jotka viittasivat potilaan allekirjoitusten väärentämiseen.
- Kelpaamattomien kliinisen tutkimuksen osallistujien rekisteröinti: Kliiniseen tutkimukseen otettiin mukaan osallistujia, jotka eivät täyttäneet Pfizerin asettamia sisäänottokriteerejä tai jotka täyttivät poissulkukriteerit. Tämä koski raskaana olevia naisia, Ventavian työntekijöitä, perheenjäseniä ja ystäviä.
- Tietojen väärentäminen ja tietojen väärentäminen: Asiakirjat osoittivat, että datapisteitä oli väärennetty ja väärennetty. Esimerkkejä ovat:
- Potilastietojen muuttaminen ja asiakirjojen takautuvuus.
- Lääkärin allekirjoitusten väärentäminen.
- Puuttuvien tai epäjohdonmukaisten tietojen väärentäminen, mukaan lukien sairaushistoria, samanaikainen lääkkeiden käyttö, fyysiset tutkimukset, elintoiminnot, verenkeräys- ja näytteiden käsittelyajat, virtsan raskaustesti ja muut olennaiset tutkimustiedot.
- Lainsäädännön noudattamatta jättäminen/muut protokollarikkomukset
- ”Sokkoa” ei ole pidetty yllä vaaditulla tavalla.
- Protokollaan vaaditut tutkimuskäynnit, mukaan lukien mahdolliset COVID-19-sairauskäynnit, joita ei ole tehty tai joita ei ole suoritettu määrätyn aikataulun ulkopuolella.
- Osallistujien sähköisen päiväkirjasovelluksen käytön seuraamatta jättäminen, jota käytettiin paikallisten reaktioiden, systeemisten tapahtumien ja injektion jälkeisen kuumetta alentavan lääkityksen käytön kirjaamiseen.
- Haittatapahtumien ja vakavien haittatapahtumien selvittämisen, keräämisen ja raportoinnin laiminlyönti, mukaan lukien tapahtuman tai sen seurausten seuranta.
- Tutkimusvalmisteen annostelu- ja antovirheet.
- Tutkimusvalmisteen lämpötilan asianmukaisen valvonnan laiminlyönti.
- Osallistujien laboratorionäytteiden virheellinen merkitseminen ja sekoittaminen.
- Epäpätevän ja kouluttamattoman tutkimushenkilöstön käyttö, mukaan lukien sokkona toimivat rokottajat ja laboratoriohenkilöstö.
- Päätutkijan valvontahäiriöt.
- Riittämätön hätäapuprotokolla akuutin allergisen reaktion sattuessa.
- Rokotuksen jälkeisten akuuttien reaktioiden arvioinnin laiminlyönti.
- Vakavien haittatapahtumien, protokollan ja säännösten rikkomisen ilmoittamatta jättäminen Pfizerille tai ulkoiselle institutionaaliselle tarkastuslautakunnalle.
- Raskauden, imetyksen ja työperäisen altistumisen aikana tapahtuvan tutkimusvalmistealtistuksen ilmoittamatta jättäminen ja seurannan laiminlyönti.
- Muut eettiset rikkomukset, mukaan lukien HIPAA:n rikkominen ja hyväksymättömän korvauksen maksaminen, jotta vältettäisiin osallistujien valitukset FDA:lle tai tiedotusvälineille.
- Ilmoitettuaan Ventavialle toistuvasti näistä huolenaiheista ilman, että mitään toimenpiteitä olisi toteutettu tutkimukseen osallistuneiden oikeuksien, turvallisuuden, hyvinvoinnin ja yksityisten terveystietojen suojelemiseksi, hän teki valituksen Center for Biologics Evaluation and Research (CBER) -virastolle, joka on FDA:n osasto, joka sääntelee ihmisille tarkoitettuja biologisia tuotteita sovellettavien liittovaltion lakien, kuten Public Health Service Actin ja Federal Food, Drug and Cosmetic Actin, mukaisesti. Ventavia irtisanoi hänet muutamassa tunnissa CBER:n ilmoittamisen jälkeen.
- FDA:n biotutkimuksen valvontaohjelma (BIMO) on ohjelma, johon kuuluu tarkastuksia paikan päällä, tietojen tarkastuksia ja sääntelyn etäarviointeja. Sen tarkoituksena on valvoa kaikkia FDA:n sääntelemien tutkimusten toteuttamiseen ja raportointiin liittyviä näkökohtia. BIMO-ohjelman tavoitteena on varmistaa FDA:lle uusien tuotteiden hyväksyntää ja markkinointihakemuksia varten toimitettujen tietojen laatu ja eheys ja samalla suojella tutkimukseen osallistuvien tutkittavien oikeuksia ja hyvinvointia [55]. Vaikka FDA:n BIMO-ohjelma sai valituksen, jossa ilmoitettiin merkittävistä rikkomuksista, se ei tarkastanut näitä kriittisiä paikkoja. Sen sijaan tarkastuksia tehtiin kuudessa muussa tutkimukseen osallistuneessa kliinisen tutkimuksen toimipaikassa. FDA:n tarkastusmuistion mukaan näissä tarkastuksissa ei havaittu ongelmia, jotka olisivat vaikuttaneet alkuperäisen EUA:n hyväksynnän tueksi toimitettuihin tietoihin.
Augusto Roux’n todistus: Haitallisten vaikutusten kirjaamatta jättäminen ja uudelleenarviointi
- Yksi Argentiinassa tehtyyn kliiniseen tutkimukseen osallistuneista, asianajaja Augusto Roux, on myös tämän raportin kirjoittajien joukossa. Hän raportoi, että kokeen aikana tapahtui useita vakavia rikkomuksia yleisiä toimintaperiaatteita ja potilasturvallisuutta vastaan. Tohtori David Healy, kanadalainen yliopistonlehtori ja lääkäri, kertoi tapahtumista yksityiskohtaisesti verkkosivustollaan [56] — sitten vertaisarvioidussa artikkelissa ”The coverage of medical injuries in company trial informed consent forms ” [57].
- Augusto Roux ilmoittautui vapaaehtoisesti tutkimukseen, jossa hänelle annettiin koehenkilönumero 12312982, ja hän sai ensimmäisen annoksensa 21. elokuuta 2020. Hän sai toisen annoksensa 9. syyskuuta 2020 klo 18.00. Toisen annoksen jälkeen hän tunsi itsensä hyvin huonovointiseksi puolitoista tuntia myöhemmin, lyyhistyi kotiin päästyään ja sai kaksi päivää myöhemmin Alemánin sairaalassa diagnoosin sydänpussitulehduksesta, jonka useat lääketieteen asiantuntijat arvioivat syy-yhteydeksi hänen saamaansa rokotteeseen: tohtori David Healyn lisäksi tohtori Gemma Torrell, barcelonalainen perhelääketieteen erikoislääkäri ja professori Joan-Ramon Laporte, yksi Espanjan johtavista lääketurvatoiminnan asiantuntijoista.
- Augusto Roux otti yhteyttä FDA:han, EMA:han ja muihin sääntelyviranomaisiin, jotka eivät käsitelleet hänen tapaustaan sen edellyttämällä vakavuudella. Hän käynnisti Argentiinassa rikostutkinnan Fernando Polackia ja muita vastaan julkisten asiakirjojen väärentämisestä ja henkilöstä luopumisesta.
- Hänen lääkärinsä antama asiantuntijalausunto on tämän kertomuksen liitteenä [58]. Nämä kolme asiantuntijaa ovat muiden vakavien yleisten hoitokäytäntöjen rikkomisten ohella raportoineet seuraavaa:
- Hänen haittavaikutuksistaan ei raportoitu oikein – ja osa niistä luokiteltiin myöhemmin uudelleen mahdolliseksi COVID:ksi sponsorin, BioNTechin, pyynnöstä.
- Esimerkiksi sydänpussitulehdusta ei yksinkertaisesti raportoitu [59].
- Hänen lääkäreilleen toimitetut kliinisten tutkimusten tiedot sisälsivät useilta potilailta kerättyjen näytteiden sekoituksia, ne eivät olleet aikajärjestyksessä ja rikkoivat muita hyviä käytäntöjä.
- Lääkäreille toimitetut tiedot vaikuttivat sekavilta ja puutteellisilta.
- Asiakirjoista käy ilmi, että tohtori Fernando Polack yritti ilman alan asiantuntemusta luokitella Augusto Roux’n mielisairaaksi ja salata vamman ja rokotteen välisen yhteyden.
- Puhelintallenteet viittaavat siihen, että kuolemantapaukset, jotka olisivat tapahtuneet kokeen aikana, olisi salattu.
Lisäindikaattorit koehenkilöiden poistamisesta tietokannasta, 301:sta puuttuvasta koehenkilötunnistetiedosta
- Kun koehenkilö rekisteröitiin, ICON-ohjelmisto (”Firecrest”, Oracle-keskustietokannan synkronoima käyttöliittymä) antoi sille yksilöllisen ja ennen kaikkea inkrementaalisen tunnisteen (”koehenkilön id” – skalaari ”SUBJID” .XPT-tiedostoissa):

- Neljä ensimmäistä numeroa on tutkimuspaikan tunnus, ja ne ovat aina samat kaikille saman tutkimuspaikan koehenkilöille. (Joissakin tapauksissa koehenkilöt vaihtoivat tutkimuspaikkaa tutkimuksen aikana, joten koko yksilöllinen koehenkilötunnus antoi tietoa sekä ”nykyisestä” että ”alkuperäisestä” tutkimuspaikasta).
- Neljä viimeistä numeroa osoitti rekisteröintijärjestyksen, joka alkoi numerosta 1001. Seuraava koehenkilö, joka rekisteröitiin tietylle testauspaikalle, sai numeron 1002, sitten 1003 ja niin edelleen.
- Tutkimuksen tunniste on ympyröity sinisellä (aina C4591001), nykyisen tutkimuspaikan tunniste on ympyröity vihreällä (tässä 1016). Alkuperäinen rekisteröintipaikka on ympyröity keltaisella. Kyseisen paikan lisääntyvän tutkimushenkilön tunniste on ympyröity punaisella.
- Näiden numeroiden — jotka ovat yleensä täysin peräkkäisiä — analyysi [60] osoittaa, että 301 koehenkilöä puuttuu toimitetuista raporteista. Tämä poikkeama vaikuttaa suhteettomasti Argentiinaan, jossa ainoa koepaikka edustaa 111:tä näistä 301:stä puuttuvasta koehenkilöstä.
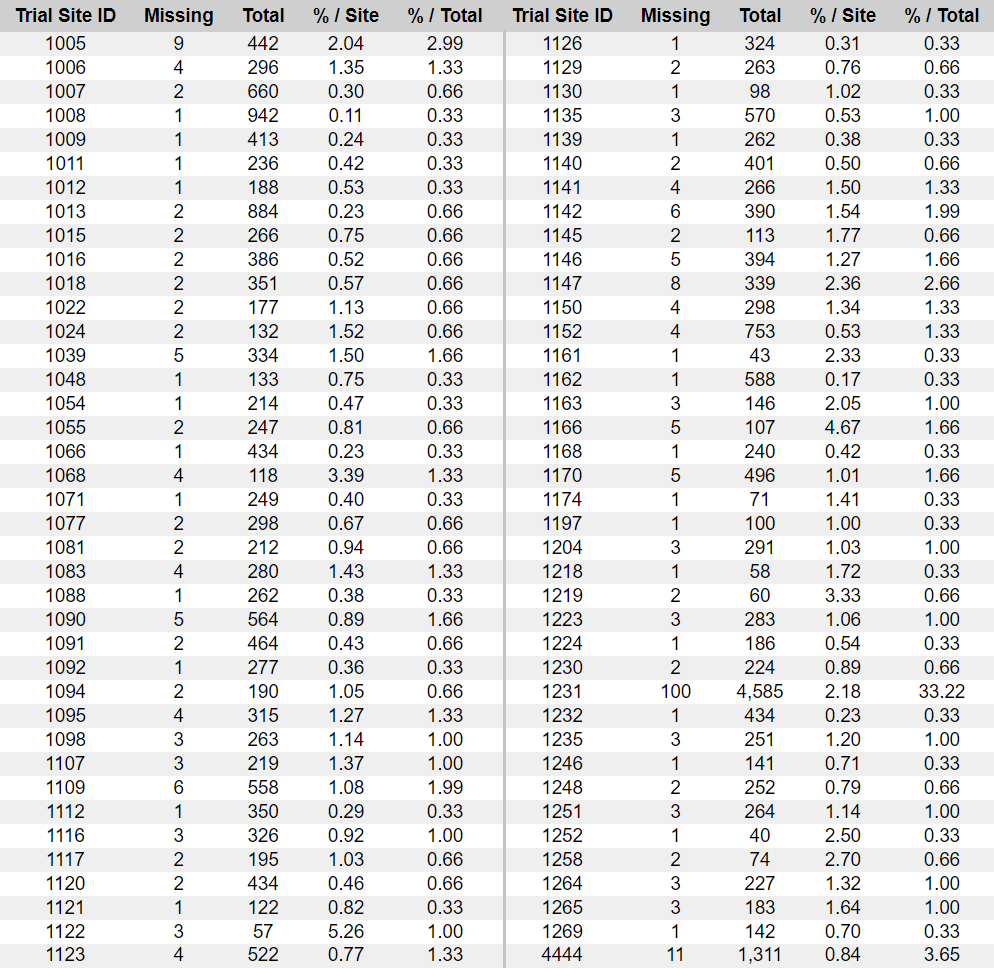
- 17 näistä koehenkilöistä — yksi merkittävimmistä eroista yhdellä koepaikalla ja yhtenä päivänä — rekrytoitiin samana päivänä kuin Augusto Roux, 21. elokuuta 2020.
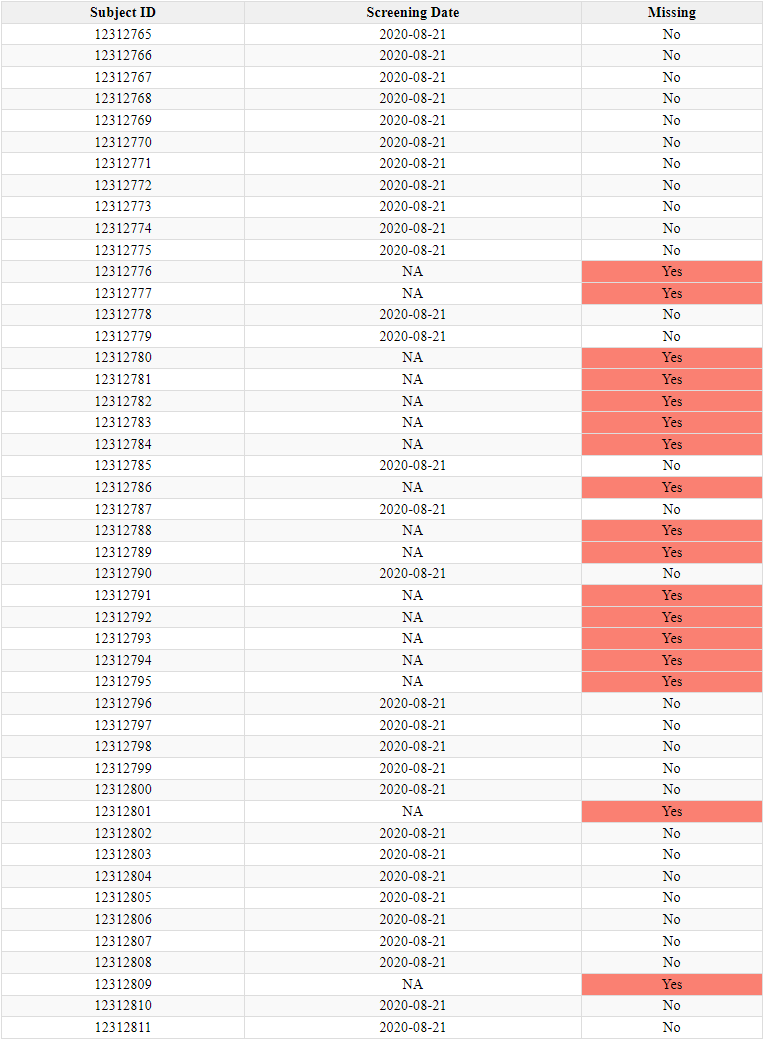
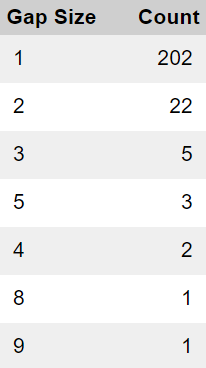
- Jos puuttuvat koehenkilötunnukset johtuisivat satunnaisvirheestä, olettaisimme, että puuttuvat tunnukset jakautuisivat tasaisesti kaikkiin tutkimuskohteisiin. Analyysimme osoittaa kuitenkin, että kuvio ei ole satunnainen, vaan puuttuvia tunnistetietoja on suhteettoman paljon vain muutamissa toimipaikoissa. Lisäksi odotimme havaitsevamme yksittäisiä puuttuvia tunnistenumeroita, mutta sen sijaan havaitsimme usein peräkkäisten puuttuvien tunnistenumeroiden klustereita, joissa puutteet vaihtelevat 2:sta 9:ään tai useampaan peräkkäiseen tunnistenumeroon. Seuraavassa jaottelussa esitetään yhteenveto erikokoisten aukkojen yleisyydestä.
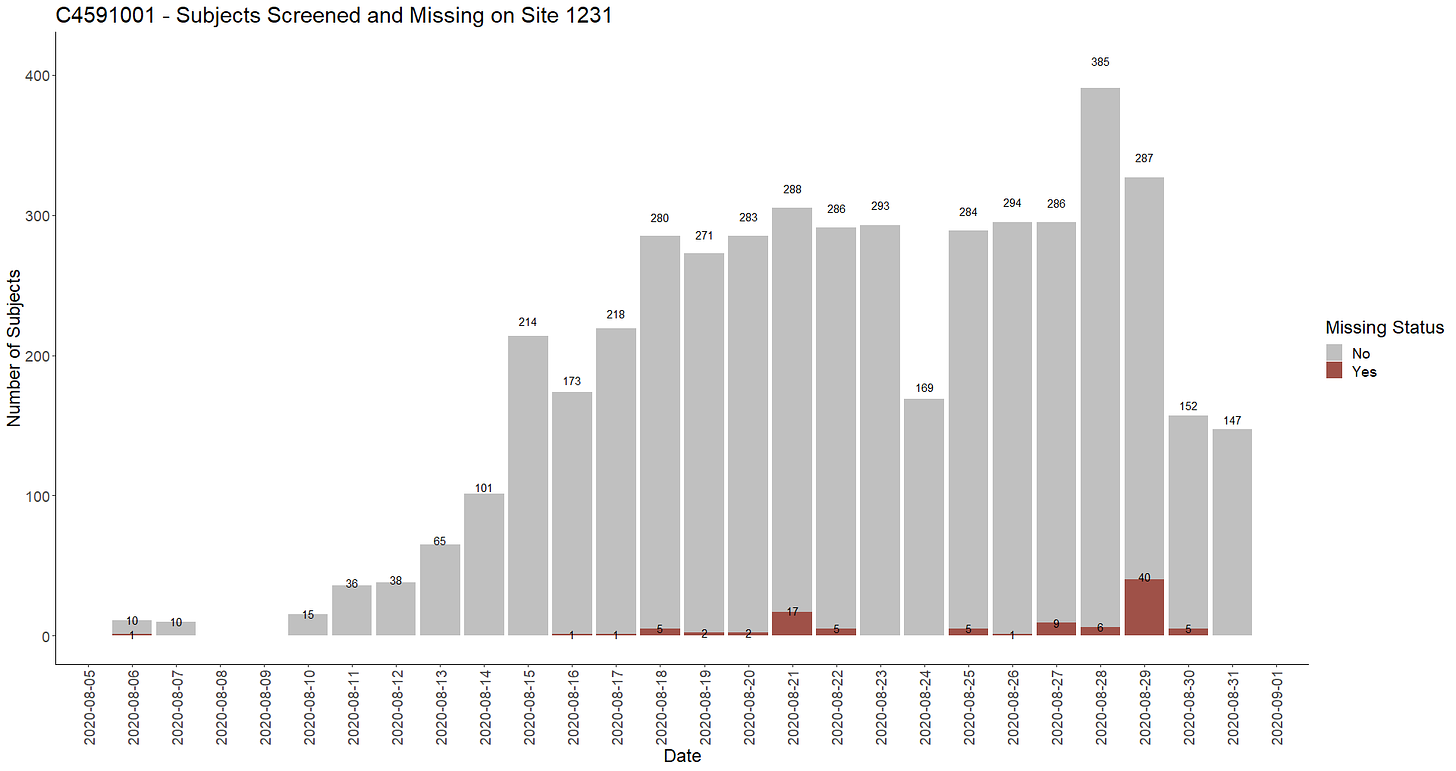
- Jos nämä puuttuvat koehenkilötunnisteet johtuisivat jostain tietokonevirheestä (vaikka se olisi kuinka epätodennäköistä, koska olemme hyvin kaukana sellaisista määristä, jotka vaikuttaisivat Oraclen tietokannan välimuistiin), odottaisimme, että niitä esiintyisi kaikkein kuormitetuimpina päivinä. Voimme esittää koepaikalle 1231 rekisteröidyn päivittäisen seulonnan ja koehenkilöt, jotka ovat saattaneet kadota päättämillämme rekrytointipäivillä, havainnollistamaan sitä, että 21. elokuuta 2020 ei ollut tämän koepaikan koehenkilöiden ilmoittautumisen kuormitetuin päivä.
Epäjohdonmukaisuudet välivaiheen tehokkuusanalyyseissä: ilmoituspäivämäärät ja yhteensopimaton koehenkilö
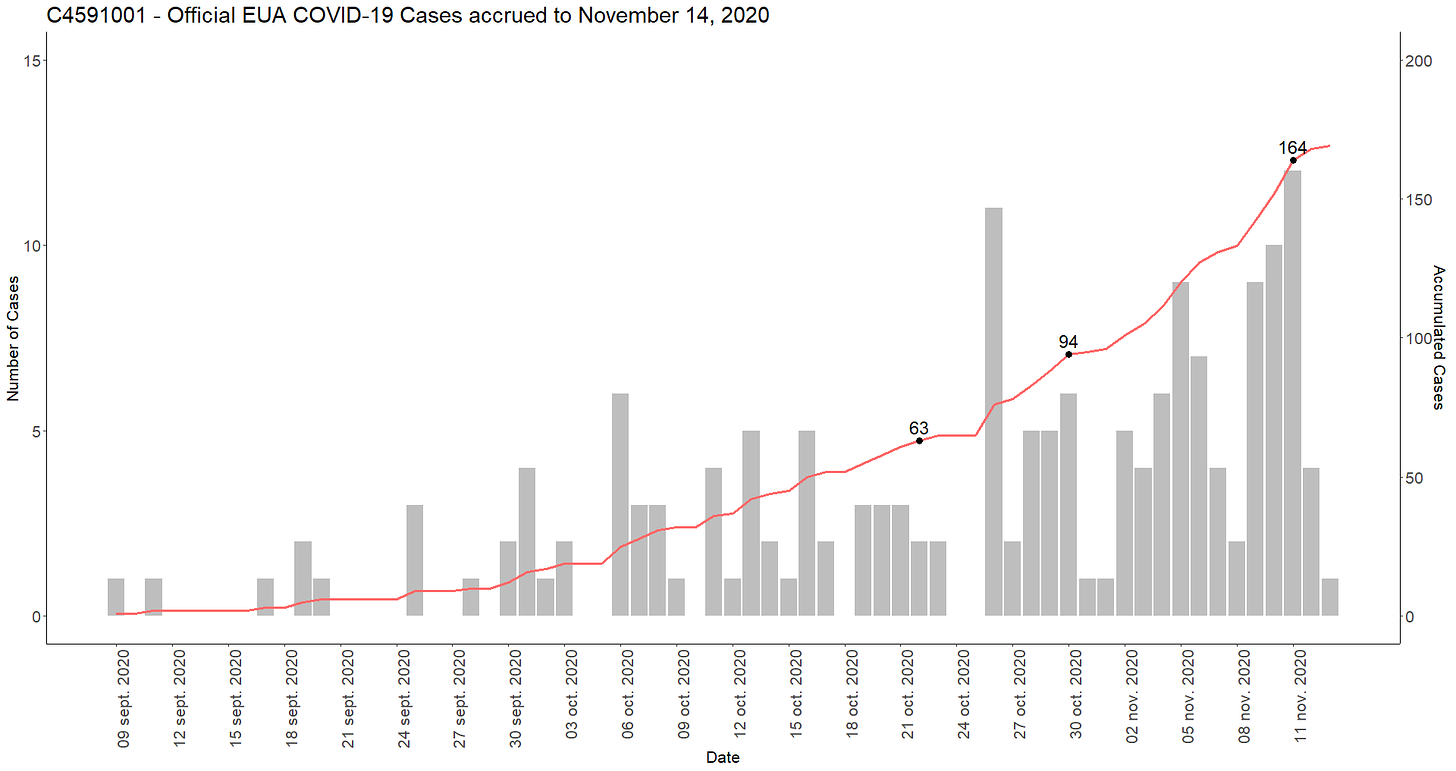
- SAP-ohjelmassa [61] tehoanalyysi tehtiin 164 tapauksessa EU:n tehokkuusselvitystä varten ja välivaiheen tehoanalyysit 62 ja 92 tapauksessa, jolloin teho voitaisiin ilmoittaa, jos se saavutetaan.
- Yhdessä toimitetuista .PDF-tiedostoista [62] on lueteltu 170 ”virallista” tehokkuustapausta, jotka on esitetty 14. marraskuuta 2020 tapahtuneena pysäytyspäivänä. Tapaukset eivät sisällä niiden keskeistä PCR-päivämäärää (jolloin Pfizer sai tiedon ja vahvistuksen tapauksesta). Näiden tapausten poimiminen [63] mahdollistaa niiden uudelleen analysoinnin [64].
- Se osoittaa myös, että Pfizerilla oli 22. lokakuuta 2020 jo tarvittavat 63 tapausta ja 30. lokakuuta 2020 jo 94 tapausta. Siitä huolimatta se odotti 9. marraskuuta 2020 asti ilmoittaakseen väliaikaisen tehokkuusanalyysin tulokset lehdistötiedotteella. On epäselvää, miksi he viivyttelivät tuotteen väitetyn tehon ilmoittamista niin kauan. Ehkä se liittyy siihen, että rokotteen saaminen oli keskeinen kysymys 3. marraskuuta 2020 pidetyissä Yhdysvaltain vaaleissa — ja Pfizerin toimitusjohtajan Albert Bourlan [65] ilmaisemaan haluun olla politisoimatta keskustelua entisestään.
Poikkeamat EUA-tehokkuustapauksissa
- Kuten tohtori Jeyanthi Kunadhasan korosti australialaisessa The Spectator -lehdessä julkaistussa artikkelissaan [66] , jossa hän raportoi työstään DailyCloutin ryhmän 3 kanssa, useat merkittävät protokollapoikkeamat ovat vaikuttaneet EUA:n virallisiin tapauksiin sisältyviin koehenkilöihin:
- 170 osallistujasta viisi (4 BNT ja 1 lumelääke) ei saanut toista annosta protokollan määrittelemän 19-23 päivän ajanjakson kuluessa. Kuten kohdassa 13 mainittiin, 19-42 päivän aikaväli mainittiin vain EUA:n asiakirjoissa [67].
- Yksi osallistuja (lumelääke) ei saanut oikeaa annosta valmistetta.
- Toinen osallistuja (lumelääke) sai verivalmistetta 60 päivän kuluessa, mikä oli merkittävä poikkeama tutkimussuunnitelmassa.
- Yksi osallistuja (44441224, lumelääke [68]) vetäytyi tutkimuksesta ennen EUA:n myöntämispäivää, mutta oli edelleen mukana 170:ssä.
Vasta-ainemittaukset & poikkeavuudet sokkokokeessa
- N-vasta-aineita tutkittiin testeillä, jotka reagoivat SARS-CoV-2 -viruksen nukleokapsidiksi (N) kutsuttuun molekyyliin. Anti-N-vasta-aineet ovat erityisen kiinnostavia, koska ainoa tunnettu tapa, jolla tutkittava voi tuottaa niitä, on COVID-19-tartunta. N-vasta-aineet mitattiin tutkimuksen aikana mNeonGreen SARS-CoV-2 ”Nucleoprotein-Binding Antibodies Assay ” [69] -menetelmällä. Kuten nimestä voi päätellä, tämä testi kohdistuu nukleoproteiiniin, joka on nukleokapsidin osa [70]. On syytä huomata, että N-vasta-aineet eivät ole täydellinen havaitsemismenetelmä, sillä havainnointitutkimusten mukaan 5,5 prosenttia tutkittavista oli negatiivisia 100 päivän kuluttua [71].
- Lumelääkehenkilöillä oli huomattavasti suurempi todennäköisyys olla osallistumatta tutkimuskäynnille 3 tai jättää vasta-aineet testaamatta tutkimuskäynnillä 3, kuten N-sitoutumisen [72] kautta tehdyt vasta-ainetestaukset osoittivat.

- 21:llä 1178:sta puuttuvasta käynnin 3 BNT:stä on positiivinen keskitetty PCR (1,78 %), ja 105:llä puuttuvasta 1392:sta lumelääkehenkilöstä on positiivinen PCR (7,5 %) (Käynti 3 suoritettiin 46-138 päivää käynnin 1 jälkeen). COVID:n havaitseminen näyttää olleen tekijä, joka vaikutti siihen, että koehenkilöt eivät olleet käyneet suunnitellulla käynnillä 3. Se ei kuitenkaan riitä selittämään kuittausta — sillä vaikka nämä positiiviset PCR-testit jätettäisiin pois, ero on edelleen merkittävä.

- 21 191 BNT- ja 21 191 lumelääkehenkilöä aloitti siten, kun PCR- ja N-sitoutumistulokset olivat negatiiviset käynnillä 1, ja he saivat ensimmäisen annoksensa. 19 928 BNT- ja 19 511 lumelääkehenkilöä olivat negatiivisia N-sitovien vasta-aineiden testauksessa käynnillä 3, ja 85 BNT-henkilöä oli positiivisia, kun taas 288 lumelääkehenkilöä oli positiivisia. 53 BNT-tapausta havaittiin keskitetyn PCR:n avulla, ja 201 Placebo-tapausta. BNT-henkilöiden joukossa oli 32 havaitsematonta tapausta (37,6 % 85 tapauksesta), kun taas plaseboryhmässä oli 87 havaitsematonta tapausta (30,2 %) — tämä osoittaa, kuinka virheellinen PCR-tunnistus oli ja kuinka valitettavaa on, ettei vasta-aineita ole mitattu käynnillä 2. Tämä osoittaa, että PCR-tunnistus oli virheellinen ja että on valitettavaa, ettei vasta-aineita ole mitattu käynnillä 2. BNT-ryhmiin kuuluvilla henkilöillä oli 7,4 % suurempi todennäköisyys välttää PCR-tunnistus, mutta heillä oli positiivisia COVID-spesifisiä vasta-aineita 1 kuukauden kuluttua annoksen 2 jälkeisestä käynnistä.
- Kommentit-tiedostossa (CO.xpt) on 9113 kommenttia, jotka liittyvät COVID-verinäytteiden ottamiseen toipilaiden käynneillä (tunnistetiedot RDOMAIN=IS ja VISIT=COVID_n), ja 8869 toipilaiden käyntiä toipilaiden käynneillä (SV.xpt) on tiedostossa Subject visits (SV.xpt) (tunnistetiedot VISIT=COVID_n). Kuitenkin vain 91 tulosta liittyy COVID-kävelyihin toipilaana IS.xpt (Immunogeenisuus) -tietokannassa (tunnistettu VISIT=COVID_n1). Protokolla sallii päällekkäiset käynnit; jos yksi käynneistä oli toipilaskäynti, näytteet oli tarkoitus kirjata sinne. Toipilasajan serologiset tulokset jäivät raportoimatta, ja vaikka selitys käynnin 3 puuttumiselle voi johtua siitä, että lumelääkehenkilöt olivat menettäneet kiinnostuksensa tutkimukseen, tämä on protokollavirhe, joka mahdollisti tietojen raportoimatta jättämisen.
Haitalliset vaikutukset COVID-käynnin uudelleenkvalifiointiin olivat laajalle levinneet.
- Augusto Roux’n todistajanlausunto, kohdat 43-46, on todiste siitä, että protokollan heikkoutta — joka koostui COVID-oireiden ja tuotteen haittavaikutusten sekoittamisesta keskenään sekä kyvystä luokitella jompikumpi niistä vaikuttamaan teho-, turvallisuus- ja immunogeenisuustuloksiin — käytettiin hyväksi.
- Lukuun ottamatta yhtä riviä, joka koskee kahta tutkittavaa (10681017 ja 10681036), kaikissa haittavaikutuksia koskevissa merkinnöissä on 1-N merkintää, jotka liittyvät tutkittavaan yksilöllisen lisäysmerkinnän ”AESPID ‘ [73] avulla, joka on dokumentoitu CSDRG:ssä [74] ’sponsorin tunnisteeksi tietyille haittavaikutuksille” (Sponsor’s ID set for the specific AEs). Sponsoreiden asiakirjassa 5 poikkeusta oli nostettu esiin 13. maaliskuuta 2021, koska toimipaikat olivat syöttäneet tässä asiakirjassa päällekkäisiä tunnuksia.
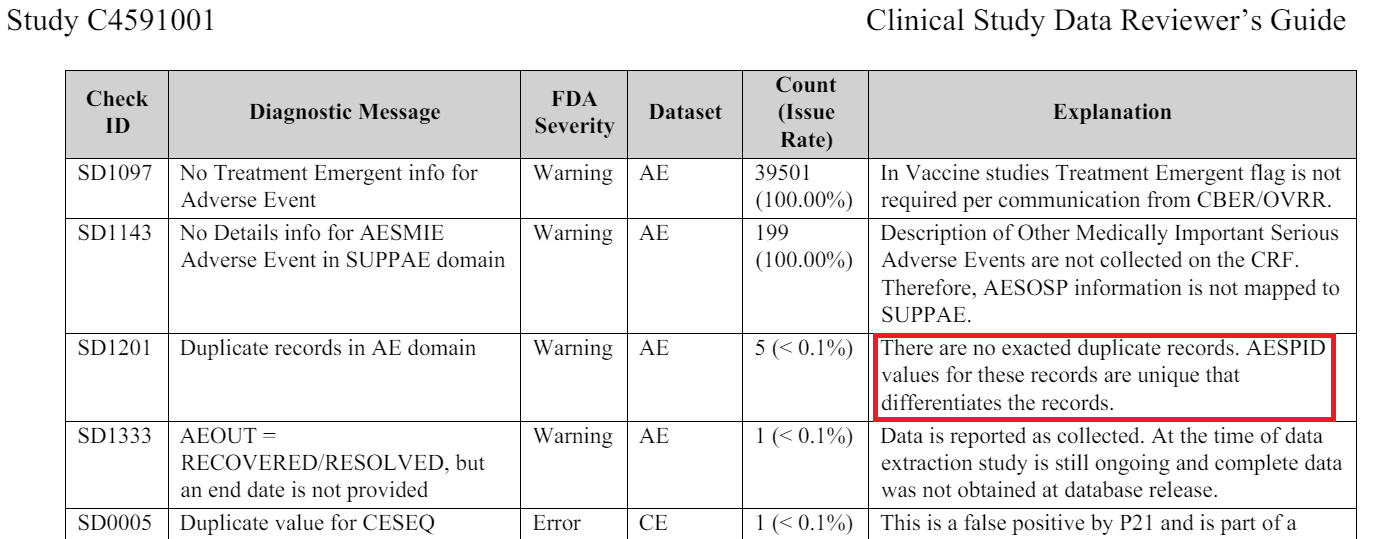
- Analysoimalla tietorakennetta, jotta voidaan havaita aukkoja näissä AESPID-tiedoissa koehenkilökohtaisesti, voidaan havaita haittavaikutukset, jotka poistettiin ja jätettiin pois turvallisuusanalyysistä: vähintään 1209 haittavaikutusta on uudelleen kelpuutettu (R) [75], 767 koehenkilön osalta. Lokin lopussa olevat haittatapahtumat välttävät havaitsemisen.
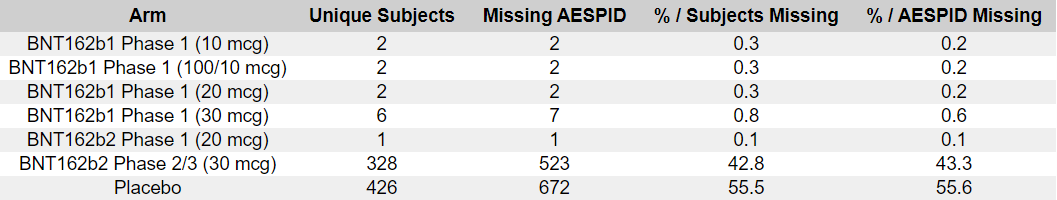
- Rajoitetun määrän koehenkilöitä (yhteensä 1028 koehenkilöä, joista 982 yksittäisissä tiedostoissa) osalta CRF on toimitettu FDA:lle BLA-hakemuksen mukana. Näistä yksilöllisistä CRF-tiedostoista 97 koskee 767 koehenkilöä (12,65 %). Tämä erittäin merkittävä osuus saatavilla olevista CRF:istä, kun taas yli 44K:n populaatiosta on saatavilla vain 2 %, saattaa selittyä sillä, että FDA:lla on kysymyksiä erityisesti osasta näistä tutkittavista — tai yksinkertaisesti sillä, että he noudattavat CRF:ien toimittamiselle asetettuja ehtoja, jotka on eritelty kokousten kirjeenvaihdossa [76].

- Koehenkilön kirjausketjun avulla voimme tunnistaa, mitkä haittavaikutukset poistettiin rekisteröinnin jälkeen, kun tapahtumat ”kelpuutettiin uudelleen” COVID-käynteihin. Kaikkien CRF-asiakirjojen poikkeavuuksien tapauskohtainen tarkastelu on myöhemmän analyysin kohteena, mutta seuraavat esimerkit kuvaavat ilmiön vakavuutta ja korostavat tarvetta yksittäisten CRF-asiakirjojen perusteelliseen tarkastukseen. Koehenkilö 12181001 [77], 32-vuotias nainen, ilmoitti ripulista 4. marraskuuta 2020. Maaliskuun 29. päivänä 2021 (16 päivää BLA-hakemuksen jättöajan päättymisen jälkeen ja 3 päivää ennen CRF-asiakirjojen jättöaikaa) tämä haittavaikutus luokitellaan uudelleen ”COVID-käynniksi”, joka on luotu taannehtivasti sponsoreiden ohjeiden mukaisesti.

- Koehenkilö 10871286 [78], 71-vuotias nainen, ilmoitti 20. lokakuuta 2020 monenlaisia haittavaikutuksia, jotka tutkimuslääkäri arvioi ”ei vakaviksi” (sivu 648-649). Nämä tapahtumat luokiteltiin uudelleen COVID-oireiksi 29. maaliskuuta 2021.
Lisänäyttöä tietojen manipuloinnista turvallisuustietojen tallenteissa
- Toinen merkittävä poikkeama haittavaikutusten kirjaamisessa on huomattava määrä ”kipua pistoskohdissa” toisen lumelääkeannoksen ja ensimmäisen BNT162b2-annoksen määrittämisvaiheen välillä niiden lumelääkkeiden kohdalla, jotka oli sokkoutettu ja joille tarjottiin mRNA-tuotetta. Nämä tapahtumat, jotka on ADAE-tiedostossa merkitty tapahtuneiksi vaiheessa ”Sokkoutuksen purkamisen jälkeen ja ennen rokotusta 3”. Kuten alla olevassa taulukossa esitetään, jotkut koehenkilöt eivät olisi saaneet edes toista annosta [79] — ja vaikka 31:llä (60,8 %) tämä jälkitapahtuma rekisteröitiin samana päivänä kuin heidän kolmas annoksensa, se on oire siitä, että kolmannen annoksen antamisen rekisteröinti viivästyi.
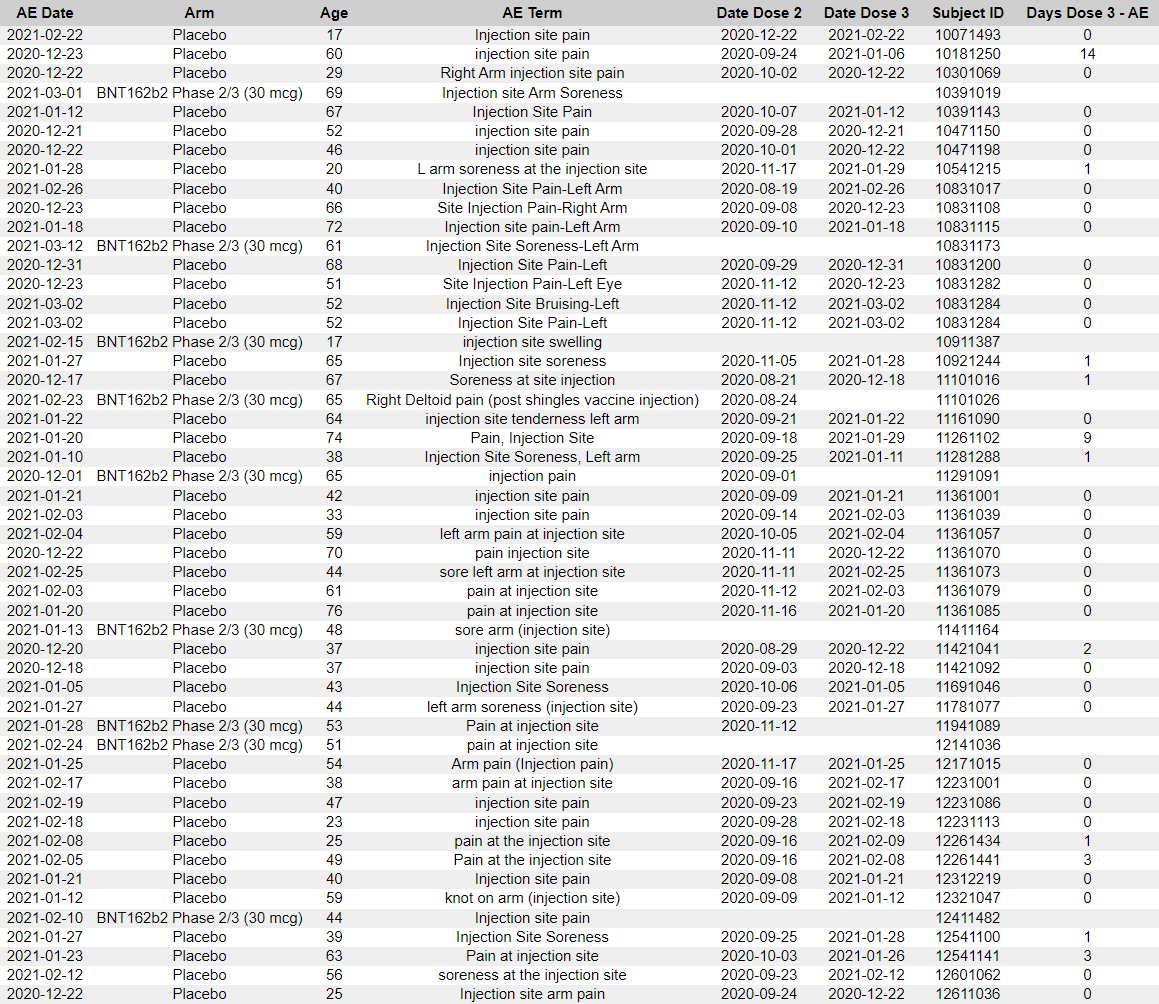
- CRF-tiedostojen manuaalisessa tarkastelussa kävi ilmi, että melko usein toimipaikat eivät kirjanneet CRF-tiedostoihin yhtään tai vain osaa esiintyneistä AE:istä. Vain muutamia esimerkkejä:
- 10551139 [80] — CRF:ssä luetellaan injektiokohdan arkuus ja vilunväristykset, kun taas haittavaikutustaulukossa (ADAE) luetellaan lisäksi vilunväristykset, pahoinvointi, oikean kainalon adenopatia ja injektiokohdan kipu [81].
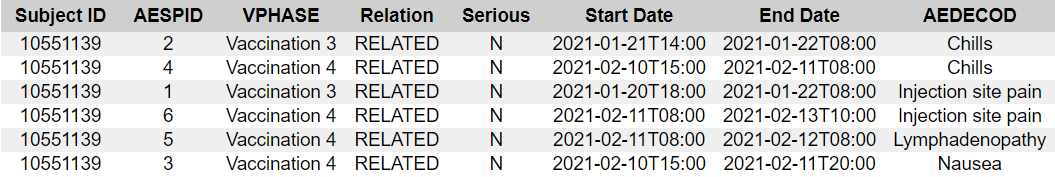
- 11401282 [82] — CRF:ssä luetellaan liikunnan aiheuttama astma, kun taas ADAE:ssä luetellaan lisäksi molemminpuolinen keuhkoembolia, syvä laskimotromboosi ja oikean yläkulman vatsakipu sekä poistettu AESPID #2. Koska CRF:ssä on vain AESPID #1, tämä tarkoittaa, että Pfizer lisäsi haittavaikutuksen ja poisti sen ennen kuin lisäsi kolme muuta tapahtumaa, joita ei ole CRF:ssä.
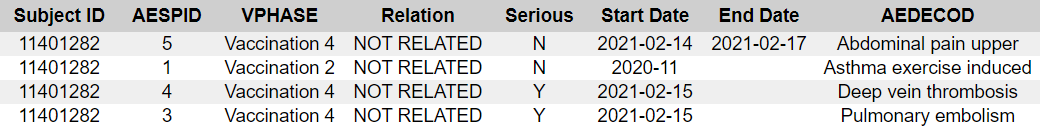
- 12411347 [83] — CRF:ssä luetellaan päänsärky, injektiokohdan kipu, lymfadenopatia ja toinen tapahtuma päänsärky, kun taas ADAE:ssä on lisäksi kolme tapahtumaa: kuume, päänsärky ja väsymys.
CRF:n AE-loki ei ilmoita yhtään AE:tä 35 koehenkilön osalta [84], ja ainakin 73 CRF:stä puuttuu tietokannassa olevia AE:itä [85], joten tämä poikkeama koskee vähintään 108 koehenkilöä vain 1028 henkilön otoksessa, mikä herättää kysymyksen siitä, onko raportointi tehty yksinomaan sponsoreiden harkinnan mukaan – ja lisäksi siitä, onko CRF-tiedostoja voitu muuttaa. Kyseessä on vähintäänkin vakava GCP-sääntöjen rikkominen, ja jos vahvistetaan, että kyseessä ei ole inhimillinen erehdys, vaan CRF-tiedostoja on muutettu, kyseessä on useiden Yhdysvaltojen [86] ja kansainvälisten säädösten [87] rikkominen.
Koehenkilöiden ilmoittamat COVID-oireet
- Jotta BNT162b2:n kykyä ehkäistä COVIDin kaltaisia oireita voitaisiin objektiivisesti kuvata, vaikuttaa tarpeelliselta ottaa huomioon, että jos koehenkilö ilmoitti kuumeesta, olipa Pfizer sitten päättänyt luokitella sen ”haittavaikutuksiksi” tai ”COVID-oireiksi” — tosiasia on edelleen se, että koehenkilö ilmoitti kuumeesta. Kuvasimme haittavaikutukset ja COVID-oireet yhdeksi tiedostoksi [88], joka edusti COVID:n kaltaisia oireita, jotta voisimme edustaa seuraavia ainutlaatuisia uusia tapahtumia, jotka koehenkilöt ilmoittivat ”sokkona” tapahtuneen tarkkailuvaiheen aikana. Katsoimme — protokollan mukaisesti — samoja oireita koskevat ilmoitukset samoista koehenkilöistä neljän päivän sisällä [89] — yhdeksi oireeksi ensimmäisen oireen esiintymispäivänä [90] riippumatta siitä, oliko koehenkilöä koskeneesta tilasta tehty ilmoitus reaktogeenisuustietokannan (FACE), haittatapahtumien (ADAE) vai COVID-oireiden (ADSYMPT) kautta. Tämä tarkoittaa, että jos tutkittava ilmoitti kuumeesta ja yskästä 18. maaliskuuta ja toisesta kuumeesta 19. maaliskuuta, hänet lasketaan vain kerran, 18. maaliskuuta.
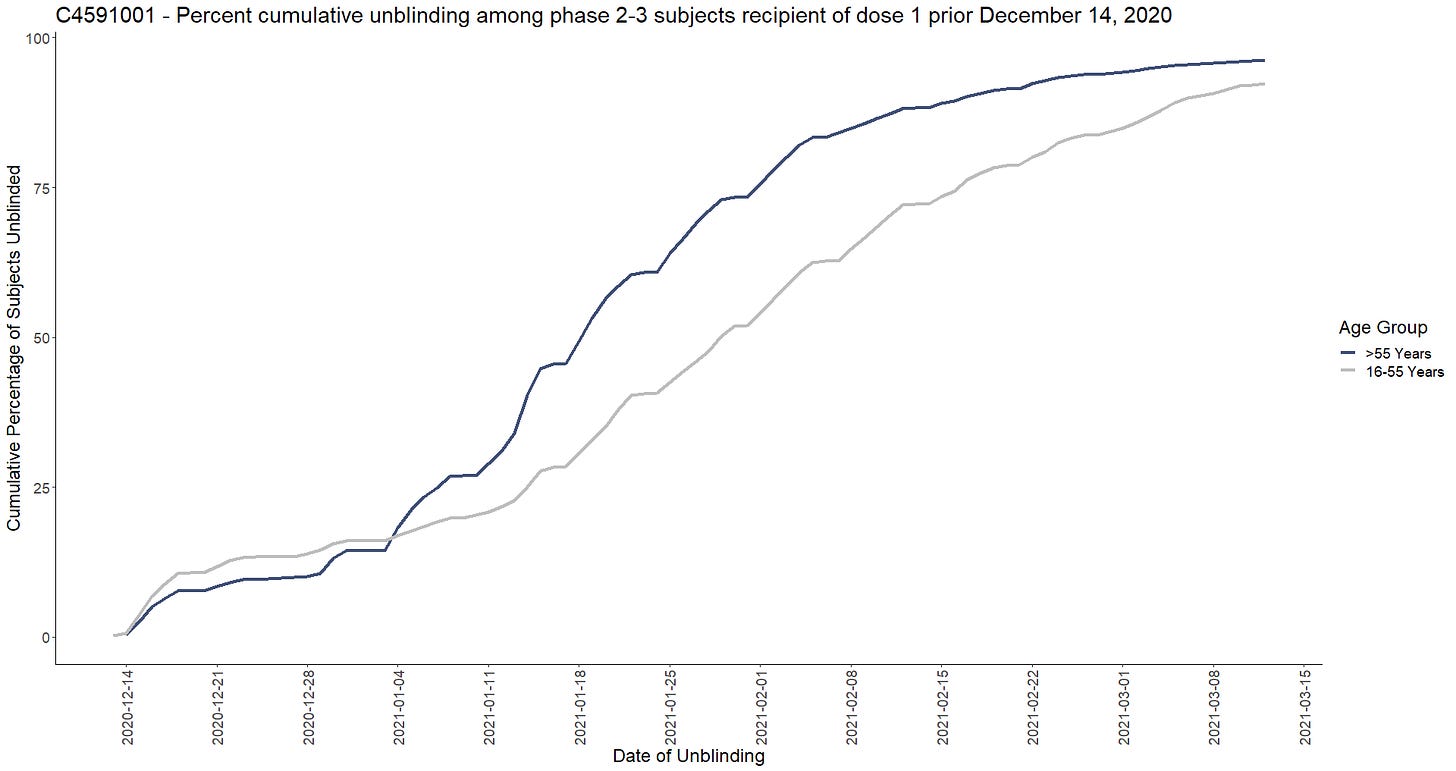
Sokkoutuksen purkamista ei satunnaistettu
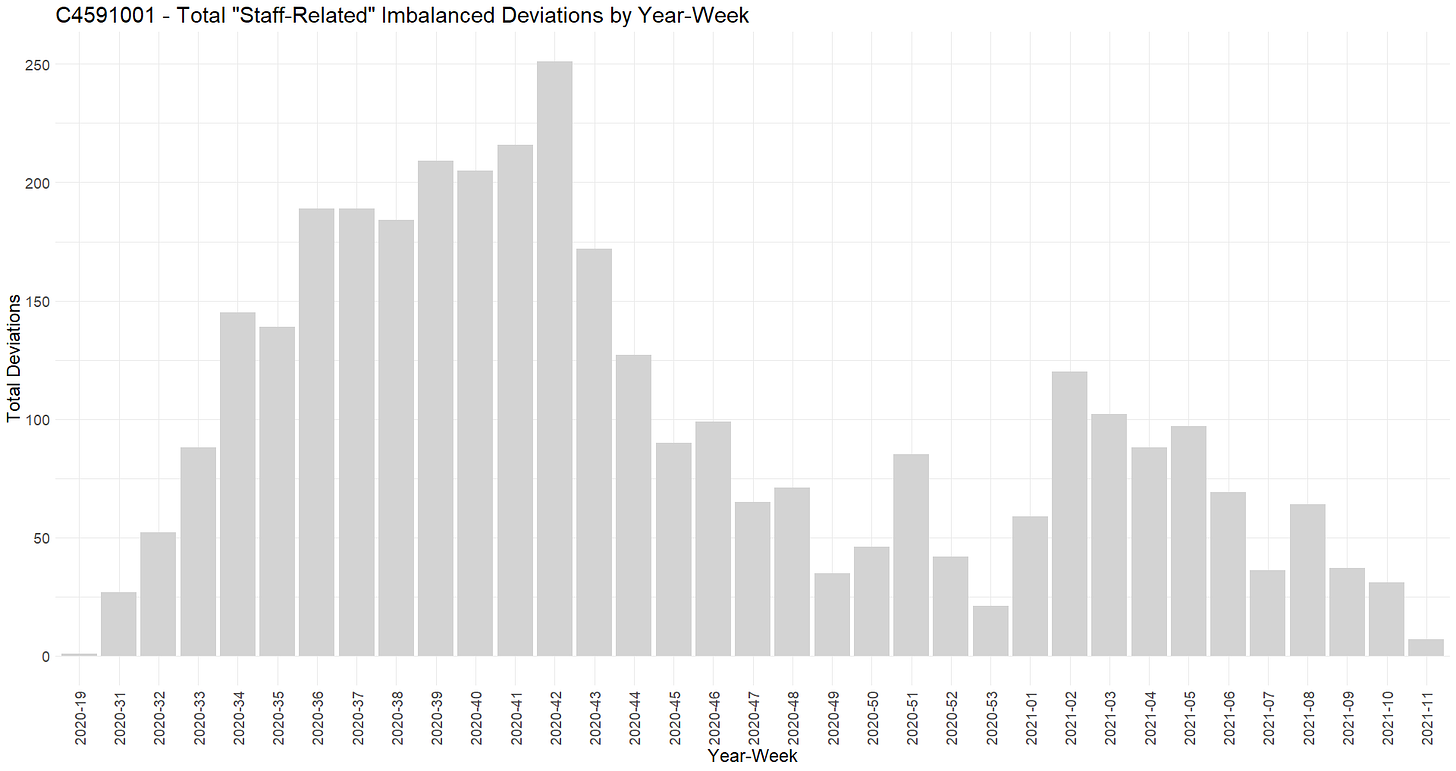
- Plasebo-vastaanottajien sokkouttaminen alkoi heti EUA:n saamisen jälkeen 14. joulukuuta 2020 (FDA antoi luvan siihen 3 päivää EUA:n jälkeen 11. joulukuuta 2020). Koehenkilöiden sokkoutus purettiin ei-sattumanvaraisesti, jolloin iäkkäämmät koehenkilöt asetettiin etusijalle – ja käytännössä lopetettiin satunnaistettu kliininen tutkimus, josta tuli avoin tutkimus, jossa oli hyvin pieni ja erittäin valikoiva plaseboryhmä. Seuraavassa kaaviossa esitetään kumulatiivisten sokkouttamisprosenttien kehitys niiden 44 040 vaiheen 2-3 koehenkilön osalta, jotka olivat saaneet ensimmäisen annoksensa ennen 14. joulukuuta 2020. [91]
Kokeen aikana tapahtuneiden kuolemantapausten oikeuslääketieteellinen analyysi
- Vertaisarvioidussa artikkelissa [92] ”Forensic analysis of the 38 subject deaths in the 6-Month Interim Report of the Pfizer/BioNTech BNT162b2 mRNA Vaccine Clinical Trial” (Michels et al., ”Oikeuslääketieteellinen analyysi 38 koehenkilön kuolemantapauksista 6 kuukauden väliraportissa Pfizer/BioNTech BNT162b2 mRNA Vaccine Clinical Trial”) todettiin, että koehenkilö nro 10841470, 65-vuotias lihava latinalaisamerikkalainen mies, jolla oli keuhkofibroosi ja verenpainetauti, kuului Pfizer/BioNTech COVID-19-rokotekokeilun lumelääkekäskyyn. Hän sai annokset 1 ja 2 lumelääkettä 30. syyskuuta ja 21. lokakuuta 2020. Hän sai kuitenkin 23. joulukuuta 2020 annoksen Moderna mRNA -rokotetta, mikä oli tutkimussuunnitelmasta poikkeava toimenpide. Hän sai myöhemmin COVID-19-oireita, joutui sairaalahoitoon ja kuoli lopulta 11. tammikuuta 2021 monielinjärjestelmän vajaatoimintaan. Tapaus ilmoitettiin virheellisesti lumelääkekuolemana, jossa COVID-19 oli toissijainen kuolinsyy, vaikka todellisuudessa koehenkilö olisi pitänyt keskeyttää tutkimuksesta, koska hän oli saanut tutkimukseen kuulumatonta COVID-19-rokotetta.
- Asiakirjassa todetaan myös, että ”BNT162b2-rokotetta saaneiden henkilöiden sydäntapahtumat lisääntyivät 3,7-kertaisesti lumelääkkeeseen verrattuna. Niistä 15 koehenkilöstä, jotka olivat aikuisten äkillisiä kuolemantapauksia (SAD) tai löydettiin kuolleina (FD), 12 kuoli sydäntapahtumaan, joista 9 oli rokotettuja.”
Kuolemantapausten viivästynyt kirjaaminen EUA-aikana
- Michels et al. korostavat toista merkittävää havaintoa, jota Jeyanthi Kunadhasan kehitti edelleen Australian Therapeutic Goods Administration (TGA) -viranomaisen kanssa käymässään kirjeenvaihdossa. Nämä Australian Medical Professional Societyn (AMPS) puolesta lähetetyt ja julkistetut kirjeenvaihdot koostuvat 21. maaliskuuta 2024 päivätystä ensimmäisestä kirjeestä [93], 27. maaliskuuta 2024 päivätystä TGA:n terveystuotteiden sääntelyryhmän professorin vastauksesta 4.2.2024 [94] ja 17. toukokuuta 2024 [95] päivätystä laajennetusta väitteestä, johon ei ole vielä vastattu. Ne ovat tämän kertomuksen liitteenä. Ne ovat jälleen yksi osoitus sääntelyviranomaisten huolellisuudesta kriittisten sääntöjenvastaisuuksien tutkimisessa — sillä TGA:n keskustelukumppani ei ilmeisesti ymmärrä ensimmäisessä kirjeessä selvitettyjä seikkoja.
- Merkittävä poikkeama on kahden kuolemantapauksen viivästynyt ilmoittaminen EUA:n luvuissa, jotka ilmoitettiin sääntelyviranomaisille ja maailmalle joulukuussa julkaistun Polackin ja muiden tutkijoiden NEJM-tutkimuksen [96] kautta. Polackin julkaisussa ilmoitettiin kuusi kuolemantapausta – kaksi BNT162b2-haarassa ja neljä lumelääkehaarassa. Sekä lehtiartikkelissa että EUA-hyväksyntäasiakirjoissa todettiin kuusi kuolemantapausta 27. heinäkuuta 2020 ja 14. marraskuuta 2020 välisenä aikana. Artikkelista käy ilmi, että Pfizer-BioNTechin kirjanpidossa oli kahdeksan kuolemantapausta EUA-aikana tapahtuneista 11 kuolemantapauksesta. Kirjoittajat osoittavat, että Pfizerilla oli selkeä tieto neljästä BNT162b2-haarassa ja neljästä lumelääkehaarassa, ja että Pfizerin olisi pitänyt ilmoittaa näistä FDA:lle. Kaksi julkistamatonta kuolemantapausta osoitti sydäntapahtumasignaalin kliinisen tutkimuksen BNT162b2-hoitoa saaneilla henkilöillä. Koehenkilö 11141050 kuoli 19. lokakuuta 2020, eli hyvissä ajoin ennen tietojen päättymispäivää 14. marraskuuta 2020. Asiakirjoista käy ilmi, että koehenkilön hätäyhteyshenkilö ilmoitti kuolemasta kliiniselle tutkimuspaikalle kuolinpäivänä, kuten protokollan vaatimukset edellyttävät. Tutkimussuunnitelmassa edellytettiin myös, että kliininen tutkimuspaikka ilmoittaa Pfizerille rokotteen SAE-lomakkeella 24 tunnin kuluessa kuolemantapauksen ilmoittamisesta. Kliininen henkilökunta odotti kuitenkin 37 päivää, ennen kuin potilaan kuolema kirjattiin Pfizerin tietoihin. Viivästyksen vuoksi Pfizer ei toimittanut tätä kuolemantapausta osana EUA:n tietoja, mikä herättää kysymyksiä viivästyksen syistä ja mahdollisista hyvän kliinisen hoitokäytännön rikkomisista.
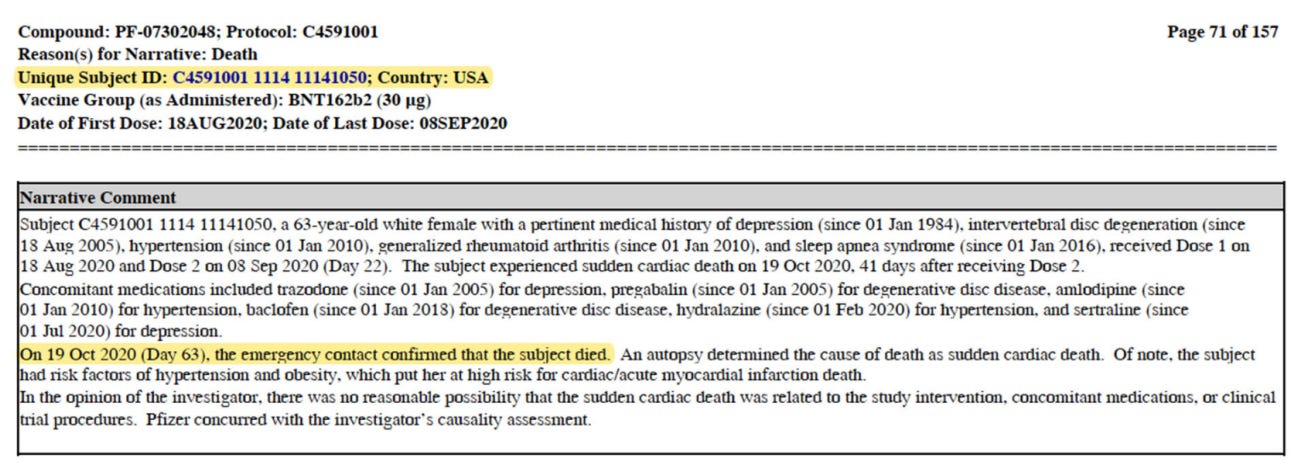
- Ruumiinavauksen mukaan potilas kuoli ”äkilliseen sydänkuolemaan”, ja hänen tiedossaan olevat riskitekijät, kuten korkea verenpaine ja liikalihavuus, aiheuttivat hänelle suuren riskin saada äkillinen sydäninfarkti. Kliinisen hoitopaikan henkilökunta kirjasi potilaan muistiinpanoihin erityisen diagnoosin ”äkillinen sydänkuolema” 9. joulukuuta 2020, päivää ennen rokotteiden ja niihin liittyvien biologisten tuotteiden neuvoa-antavan komitean (VRBPAC) kokousta 10. joulukuuta 2020, mikä viittaa siihen, että myös tämän salatun kuolemantapauksen ruumiinavaustulokset olivat saatavilla rokotteen hätäkäyttöluvan kriittisessä käsittelyvaiheessa.
- Osallistuakseen tähän kliiniseen tutkimukseen osallistujien oli oltava terveitä anamneesin, fyysisen tutkimuksen (jos tarpeen) ja tutkijan kliinisen arvion perusteella. Tutkimussuunnitelmassa sallittiin terveiden osallistujien osallistuminen kliiniseen tutkimukseen, joilla oli jo ennestään vakaa sairaus, joka määriteltiin sairaudeksi, joka ei vaatinut merkittävää hoitomuutosta tai sairaalahoitoa sairauden pahenemisen vuoksi kuuden viikon aikana ennen tutkimukseen osallistumista. Verenpainelukema puuttuu hänen julkisesti saatavilla olevista potilaskertomuksistaan. Näin ollen voimme vain olettaa, että potilaan korkea verenpaine, josta hän oli kärsinyt 1. tammikuuta 2010 lähtien, oli hyvin hallinnassa, kun hänet otettiin tutkimukseen. Potilas painoi 74,1 kg ja oli 165 cm pitkä. Näin ollen hänen painoindeksinsä 27,2 sijoitti hänet ylipainoluokkaan, ei lihavaan luokkaan, kuten kohdassa 74 todetaan.
- Koehenkilö 11201050 kuoli 7. marraskuuta 2020. Hänen aviomiehensä ilmoitti hänen kuolemastaan kliiniselle tutkimuspaikalle 7. marraskuuta 2020. Hän kuoli unissaan 72 päivää sen jälkeen, kun hän oli saanut rokoteannoksen 2. Sairaalakäyntiä tai ruumiinavausta ei tehty. Kuolemansyyntutkija totesi hänen kuolemansa ja merkitsi kuolintodistukseen kuolinsyyksi sydänpysähdyksen.

- Koska ruumiinavaustuloksia ei ollut saatavilla, on epäselvää, miten rahoittajat tai sääntelyviranomaiset päättelivät, että kuolemantapauksen ei voitu katsoa johtuneen hoidosta. Pfizer dokumentoi saaneensa ilmoituksen hänen kuolemastaan 7. marraskuuta 2020, paljon ennen tietojen päättymispäivää 14. marraskuuta 2020. On selvitettävä, miksi tätä rokotukseen liittyvää kuolemantapausta ei julkistettu VRBPAC:n kokouksessa 10. joulukuuta 2020 tai Polack New England Journal of Medicine -julkaisussa.
Vahvistetaan Michelsin ym. arvio massiivisesti aliraportoiduista kuolemantapauksista
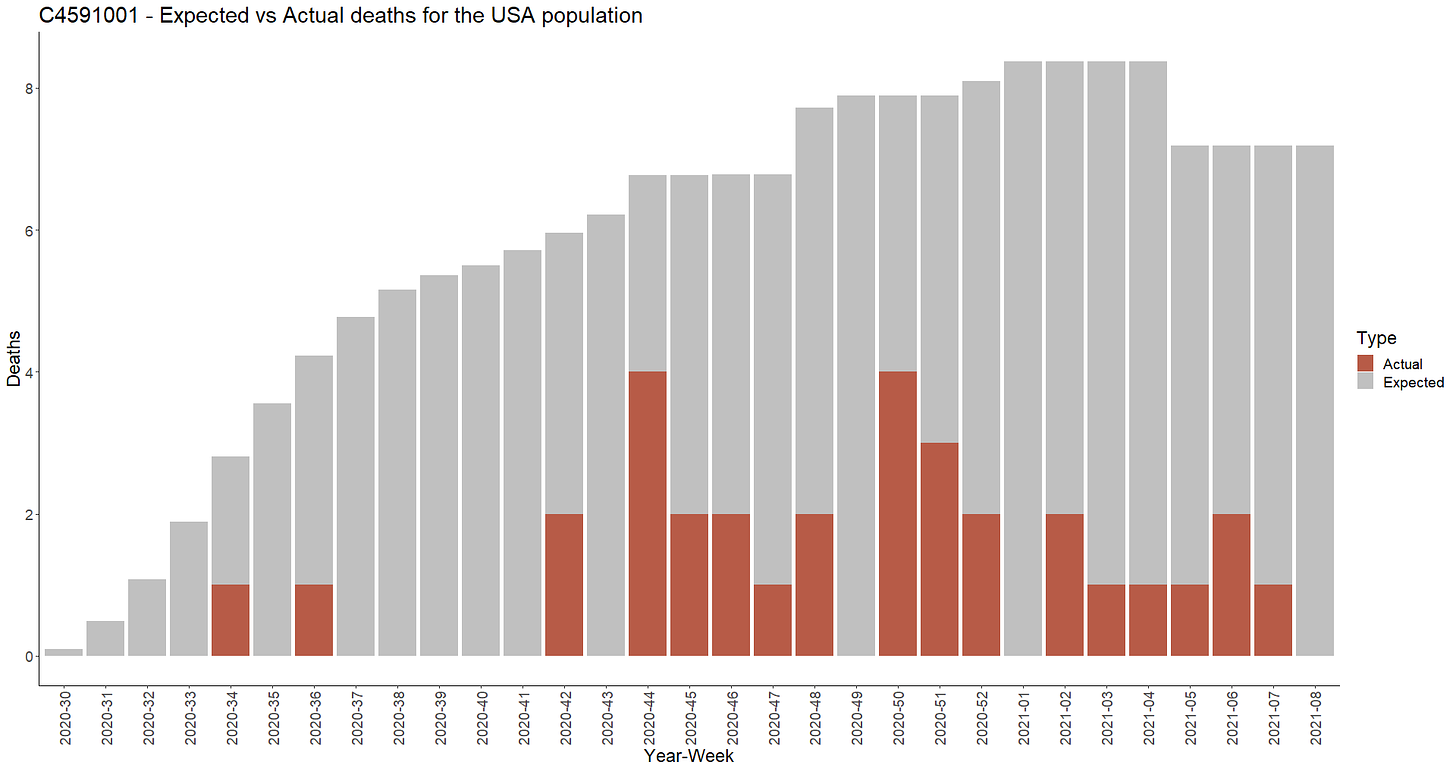
- Michels et al. toteavat, että ”koehenkilöiden kuolemantapausten määrä oli 17 % odotetusta määrästä, joka perustui ikään mukautettuun kuolleisuuteen Yhdysvalloissa. Yksi mahdollinen selitys voisi olla 395 koehenkilön ”jatkotutkimuksista katoaminen”. Toinen selitys näille alhaisille kuolemantapauksille voisi olla se, että tutkijoiden tiedostoissa oli 1203 tutkittavaa, jotka on merkitty kohdissa 23-25 – ja/tai se, että kohdissa 47-51 on merkitty (ainakin) 301 puuttuvaa tietuetta.
- Yksikään BNT162b2-vastaanottaja ei kuollut raportoitujen lukujen mukaan Yhdysvaltojen ulkopuolella. Kuolemantapaukset Yhdysvalloissa ovat 19 BNT162b2:n jälkeen, 12 plasebon jälkeen ja 2 plaseboa ensin saanutta henkilöä, jotka olivat sen jälkeen saaneet vähintään yhden BNT162b2-annoksen, eli yhteensä 33 kuolemantapausta Yhdysvalloissa. Viisi lumelääkettä saanutta henkilöä kuoli Yhdysvaltojen ulkopuolella.
- Otimme kuolleisuustiedot osavaltioittain, vuoden, kuukauden ja 5 vuoden ikäryhmien mukaan vuosilta 2020 ja 2021 CDC:n Wonder Underlying Causes of Death -alustalta [97] — ja loimme vientitiedot [98] sekä toisen vientitiedon [99] väestötiedoista [100], jotka on kerätty vuosittain heinäkuun 1. päivän väestölaskennan tietojen perusteella osavaltioittain. Tämän avulla voitiin vertailla Yhdysvaltojen tutkimuslaitosten raportoimaa kuolleisuutta ( ja kuolleisuutta, jota olisi voitu odottaa tämän ikäiseltä kohortilta. Terveiden käyttäjien harhapainotteisuus voisi mahdollisesti vaikuttaa asiaan, mutta se, että havaittiin yksi ”dementiaan” johtanut kuolema, antaa aiheen kyseenalaistaa tutkimuksen aikana rekrytointiin sovelletut standardit. Tämä ei kuitenkaan voi selittää sitä, miten merkittävästi pienempi havaittu kuolleisuus on kuin mitä olisi voitu odottaa 33689 satunnaistetun henkilön [101] populaatiossa — vain 18 prosenttia odotetusta kuolleisuudesta on raportoitu.
Prosessi 1 & prosessi 2: yleiskatsaus niiden eroista
- Pfizer/BioNTech käytti COVID-19-rokotekandidaatin BNT162b2:n (kauppanimeltään Comirnaty) kehityksessä kahta erillistä valmistusmenetelmää, joita he kutsuivat ”prosessiksi 1” ja ”prosessiksi 2”.
- Kliinisen tutkimuksen tutkimussuunnitelmassa [102] todetaan: ”Alkuperäinen BNT162b2 valmistettiin ’prosessilla 1’, mutta ’prosessi 2’ kehitettiin tukemaan valmistuksen laajempaa mittakaavaa.” Lisänäyttöä löytyy muista Yhdysvaltain FDA:n, Japanin lääke- ja lääkinnällisten laitteiden viraston (PMDA), TGA:n ja Euroopan lääkeviraston (EMA) sääntelyasiakirjoista. Yhtenä esimerkkinä mainittakoon, että EMA:n 19. helmikuuta 2021 päivätyssä Comirnatya koskevassa tuotearviointikertomuksessa (PAR) todetaan seuraavaa: ”Kehityshistorian aikana on käytetty kahta vaikuttavan aineen prosessia: prosessi 1 (kliinisen tutkimuksen materiaali) ja prosessi 2 (kaupallinen prosessi) ” [103].
- Kohdassa 83 mainitun EMA:n PAR:n lausunnon lisäksi, jonka mukaan prosessia 1 käytettiin kliinisten koeannosten valmistukseen ja prosessia 2 kaupallisiin annoksiin, Japanin PMDA:n 8. helmikuuta 2021 päivätyssä ”Report on Special Approval for Emergency” (raportti hätätilanteessa myönnettävästä erityishyväksynnästä) lausunnossa todetaan seuraavaa: ”Ei-kliinisissä ja kliinisissä tutkimuksissa käytetty vaikuttava aine valmistetaan prosessilla 1 ja ehdotetun kaupallisen formulaation vaikuttava aine prosessilla 2” [104].
- Lokakuun 6. [105] päivättyyn pöytäkirjaan tehdyssä tarkistuksessa 7 todetaan seuraavaa: ”Lisättiin ylimääräinen tutkiva tavoite turvallisuuden ja immunogeenisuuden kuvaamiseksi 16-55-vuotiailla osallistujilla, jotka on rokotettu tutkimusinterventiolla, joka on tuotettu valmistusmenetelmällä ’Process 1’ tai ’Process 2’.”. Tätä muutosta käsitellään tarkemmin kohdassa 6.1.1: ”BNT162b2:n valmistuksen mittakaavaa on kasvatettu tulevien toimitusten tukemiseksi. BNT162b2:ta, joka on tuotettu lisääntynyttä tarjontaa tukevalla valmistusprosessilla (”prosessi 2”), annetaan tutkimuksessa noin 250:lle 16-55-vuotiaalle osallistujalle erää kohti. Tutkimuksessa kuvataan ennaltaehkäisevän BNT162b2:n turvallisuutta ja immunogeenisuutta 16-55-vuotiailla henkilöillä, jotka on rokotettu materiaalilla, joka on tuotettu nykyisellä valmistusprosessilla (prosessi 1), ja materiaalilla, joka on tuotettu eristä, jotka on tuotettu lisääntynyttä tarjontaa tukevalla valmistusprosessilla (prosessi 2) ” [106].
- Kohdassa 65 siteeratussa kliinisen tutkimuksen pöytäkirjassa esitetään tiivistetysti kolme keskeistä eroa prosessien 1 ja 2 välillä: ”Prosessimuutokset liittyvät DNA-mallin tuotantomenetelmään, josta RNA-lääkeaine transkriboidaan, ja RNA-lääkeaineen puhdistusmenetelmään. BNT162b2-lääkevalmistetta valmistetaan tämän jälkeen käyttämällä skaalattua LNP-valmistusprosessia ” [107].
- Erot prosessien 1 ja 2 välillä eivät ole vähäpätöisiä. TGA:lta saadussa asiakirjassa [108] esitetään yksityiskohtaisesti joitakin keskeisiä muutoksia, jotka on tehty prosessien 1 ja 2 välillä, vaikka monet yksityiskohdat on poistettu. Prosessissa 1 mRNA:n transkriptioon tarvittava DNA-malli tuotettiin PCR-amplifikaation avulla; prosessissa 2 käytetään linearisoitua plasmidi-DNA:ta, jota viljellään E. coli -bakteereissa. Linearisoidussa plasmidi-DNA:ssa käytetään plasmidi-DNA:ta, joka on pieni, pyöreä, kaksijuosteinen DNA-molekyyli, jota tavallisesti esiintyy bakteereissa. Muissa (osittain redusoiduissa) yksityiskohdissa kuvattiin muutoksia in vitro -transkriptioreaktion tilavuuteen, erän mittakaavaan ja puhdistusmenetelmään (magneettihelmet prosessissa 1; proteinaasi K -käsittely proteiinien pilkkomiseksi ja niihin liittyvien nukleiinihappojen vapauttamiseksi, jota seuraa tangentiaalinen virtaussuodatus prosessissa 2).
Prosessin 2 erien tunnistaminen
- Joissakin sääntelyasiakirjoissa prosessiin 1 viitataan joskus ”klassisena” prosessina ja tuloksena olevaan tuotteeseen viitataan ”kliinisenä toimituksena”. Prosessiin 2 viitataan toisinaan nimellä ”upscale”-prosessi, ja sen tuloksena syntyviin tuotteisiin viitataan nimellä ”emergency” tai ”commercial” supply. Tämä käy ilmi TGA:n julkaisemasta asiakirjasta. Kyseessä on FOI 3659 -asiakirja 4, jonka otsikko on ”BNT162b2 (PF-07302048) Comparability Report for PPQ Drug Product Lots ”109 ja jossa luetellaan jaetut erät, niiden käyttö ja vastaavat tuotantoprosessit.
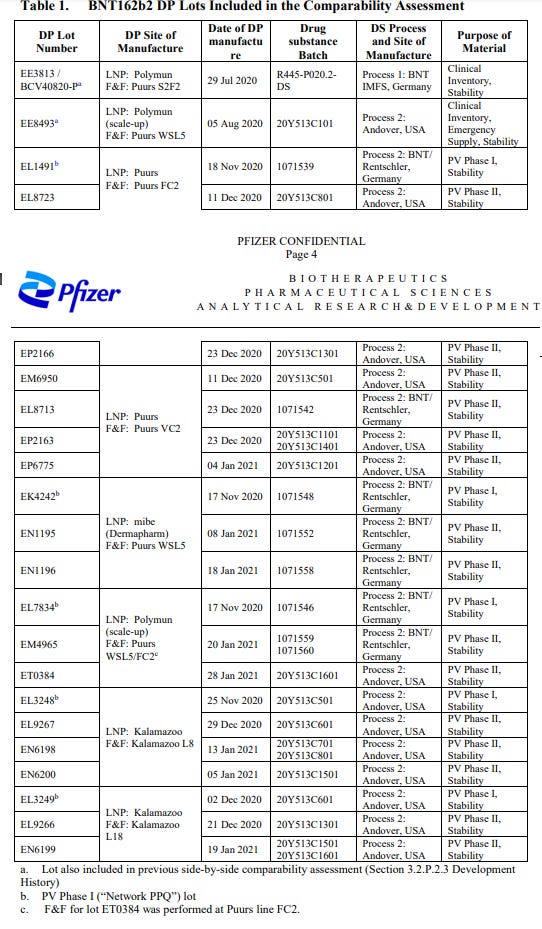
- Vertailukelpoisuusraportissa erotellaan kliiniset, hätä- ja kaupalliset toimituserät seuraavasti: ”Lääkevalmisteen valmistusprosessi on kehittynyt kliinisestä toimituksesta hätäaputoimituksiin ja lopulta kaupallisiin toimituksiin, jolloin se on siirretty eri valmistuspaikkoihin ja prosessia on skaalattu. Kliininen tuotanto valmistettiin alun perin Polymunissa Itävallassa (”klassinen” prosessi). LNP-prosessin massan läpimenon parantamiseksi ja eräkoon kasvattamiseksi prosessi skaalattiin Polymunissa (”upscale”-prosessi), minkä jälkeen irtotavarana oleva lääkevalmiste (valmiiksi formuloidut LNP:t ennen steriilisuodatusta) kuljetettiin Pfizer Puursiin, Belgiaan täyttöä/viimeistelyä varten (hätäaputoimitusten ja kaupallisten toimitusten valmistusta varten). Tämä prosessi on otettu käyttöön myös mibe:ssä (Dermapharm) Saksassa hätäaputarvikkeiden valmistusta varten. Tässä yhteydessä Puursin täyttö-/viimeistelytoiminnot suoritettiin aluksi S2F2-linjalla (kliinisiä toimituksia varten) ja siirryttiin WSL5-linjalle suurempien erämäärien valmistamiseksi (hätätoimitukset ja myöhemmin kaupalliset toimitukset). Rutiininomaista kaupallista tuotantoa varten LNP-tuotantoprosessi on siirretty kokonaan Pfizeriin, Puursiin, Belgiaan, jossa täyttö-/viimeistelytoiminnot tapahtuvat täyttölinjoilla WSL5, FC2 ja VC2, ja Pfizeriin, Kalamazoon, Yhdysvaltoihin, jossa täyttö-/viimeistelytoiminnot tapahtuvat täyttölinjoilla L8 ja L18 (kaupallisten toimitusten valmistusta varten).” [110].
- Samasta asiakirjasta voidaan tunnistaa, mitkä erät ovat prosessia 1 tai prosessia 2, sivun 4 taulukossa 1 ja sivun 11 taulukon 3 huomautuksissa b ja e lueteltujen erien perusteella. Lisätietoa erien valmistusprosessista löytyy FDA:n FOI:n perusteella julkaisemasta asiakirjasta [111]. Asiakirjan nimi on ”125742_S2_M3_32p5_batch_analyses.pdf”. – Asiakirjan sivulla 4 oleva taulukko 3.2.P.5.4-1 ”Summary of BNT162b2 Drug Product Lots” (Yhteenveto BNT162b2-lääke-eristä) sisältää asiaa koskevat tiedot. Jäljempänä viitataan molempiin asiakirjoihin.
Kliinisessä lääketutkimuksessa C4591001 käytettyjen prosessin 2 erien määrittäminen
- FDA:n julkaisemassa asiakirjassa kerrotaan yksityiskohtaisesti, mitkä erät oli toimitettu millekin kliiniselle tutkimuspaikalle noin 6 kuukauden kuluttua tutkimuksen alkamisesta. Se on päivätty 17. maaliskuuta 2021 ja otsikoitu ”125742_S1_M5_5351_c4591001-interim-mth6-patient-batches.pdf ” [112]. Asiakirjassa luetellaan seuraavat yksilölliset eränumerot: BCV10320-A, BCV10420-A, BCV20420-A, BCV40420-A, BCV40620-A, BCV40620-B, BCV40620-C, BCV40620-D, BCV40720-A, BCV40720-B, BCV40720-C, ED3938, EE3813, EE8493Z ja EJ0553Z. Ei ole selvää, mitä erien EE8493 ja EJ0553 lopussa oleva Z tarkoittaa. Muissa asiakirjoissa nämä erät on lueteltu ilman Z-liitettä. Sitä on saatettu käyttää osoittamaan, että nämä kokeessa käytetyt erät olivat peräisin prosessista 2.
- Edellä 88 ja 90 kohdassa mainittujen TGA:n ja FDA:n asiakirjojen taulukoiden perusteella kaikki erät, jotka alkavat kirjaimella ”BCV”, ovat prosessin 1 eriä. Erä ED3983 on lueteltu 90 kohdassa mainitun FDA:n eränanalyysiasiakirjan taulukossa 3.2.P.5.4-1 ”kliinisenä” eränä, ja se on merkitty huomautuksella a, joka on määritelty sivulla 13 seuraavasti: ”vastaa BCV40720-P:tä”, joka vahvistettiin prosessin 1 eräksi 91 kohdassa. Erä EE3813 on molemmissa taulukoissa merkitty prosessin 1 kliiniseksi eräksi.
- Kohdassa 91 mainitussa 6 kuukauden potilaseriä koskevassa asiakirjassa yksilöidään kaksi prosessin 2 erää: EE8493 ja EJ0553. Erä EE8493 mainitaan prosessin 2 eränä edellä 90 kohdassa mainitun TGA:n ”Comparability Report for PPQ Drug Product Lots” -asiakirjan taulukossa 1 (ks. sarake ”DS Process and Site of Manufacture”). Erä EJ0553 on lueteltu TGA:n vertailukelpoisuusraportissa sivulla 11 olevan taulukon 3 huomautuksessa ”d”. Taulukon 3 huomautus ”d” on liitetty sarakkeeseen ”Historical Range: Emergency Supply”, mikä osoittaa, että EJ0553 on hätäaputoimituserä, joka oli toinen termi prosessille 2. Huomautuksessa ”d” täsmennetään lisäksi, että erän EJ0553 valmistuspaikka oli ”Polymun/Puurs WSL5”, mikä kohdassa 88 siteeratun asiakirjan kuvauksen perusteella antaa lisätodisteita siitä, että EJ0553 oli hätäaputoimituserä eikä kliininen erä, koska kaikki taulukossa 1 olevat erät, joiden ”DP Site of Manufacture” -kenttään on merkitty ”Polymun/Puurs WSL5”, ovat prosessi 2 -eriä. Tämä on täysin yhdenmukainen sivulla 3 olevan valmistusprosessin kehittymistä koskevan kuvauksen kanssa, jota on lainattu edellä 70 kohdassa. Monet muut huomautuksessa ”d” mainitut erät on lueteltu TGA:n vertailukelpoisuusraportin sivuilla 4-5 olevassa taulukossa 1, ja ne on kaikki merkitty prosessin 2 eriksi, eikä yksikään huomautuksessa ”d” taulukossa 3 luetelluista eristä ole taulukossa 1 kliinisenä eränä (prosessi 1). Lisäksi kaikki kliiniset erät on lueteltu erikseen taulukon 3 huomautuksessa ”b” sivulla 11. Erä EJ0553 on lueteltu kohdassa 90 mainitussa FDA:n ”Batch Analysis” -asiakirjassa sekä hätätoimitus- että kliinisenä eränä. Koska erä EE8493 on myös lueteltu sekä hätätoimituseränä että kliinisenä eränä, tämä osoittaa, että sekä EE8493:aa että EJ0553:a käytettiin jossakin määrin kliinisessä tutkimuksessa ja että ne olivat myös osa hätätoimituserää.
- Lisäksi lähes kaikki haittavaikutukset, jotka on raportoitu [113] Yhdysvaltojen tautienvalvontakeskuksen rokotteiden haittavaikutusilmoitusjärjestelmässä (VAERS [114]) erien EE8493 ja EJ0553 osalta, on rokotettu sen jälkeen, kun Comirnaty oli hyväksytty väliaikaiseen käyttöön Yhdistyneessä kuningaskunnassa. VAERS-järjestelmässä [115] ei ole raportteja haittavaikutuksista yhdestäkään muusta erästä, joka on lueteltu tutkimuspaikoille toimitetuksi. Tämä antaa lisätodisteita siitä, että EE8493 ja EJ0553 olivat prosessin 2 valmisteita, koska niitä jaettiin ja annettiin kaupallisesti myyntiluvan myöntämisen jälkeen.
Todisteet siitä, että erää EE8493 käytettiin prosessien 1 ja 2 suunniteltuun vertailuun
- On kaksi tapaa tunnistaa, että erää EE8493 käytettiin osana suunniteltua vertailututkimusta prosessien 1 ja 2 välillä, kuten 85 kohdassa mainitussa kliinisen tutkimuksen pöytäkirjassa on kuvattu. Ensimmäinen tapa on tunnistaa, mitkä prosessin 2 erät toimitettiin mihin kliinisen tutkimuksen tutkimuspaikkoihin, ja laskea, kuinka monta hoidettavaa otettiin mukaan vertailututkimuksen alusta alkaen (ks. jäljempänä kohdat 98-99). Toiseksi osoitetaan, että osallistujien osajoukon satunnaistamisnumerot erosivat kaikista muista (ks. jäljempänä kohta 100). Nämä toisistaan riippumattomat menetelmät johtavat samaan tulokseen: vain 252 koehenkilöä, joille annettiin rokoteannoksia erästä EE8493, otettiin lopulta mukaan suunniteltuun vertailuun.
- Vastauksessaan FOI-pyyntöön 23/510 Yhdistyneen kuningaskunnan Medicines & Healthcare products Regulatory Agency (MHRA) todisti, että ”ensimmäinen kliininen erä, joka sisälsi prosessin 2 lääkeaineita, annosteltiin 19. lokakuuta 2020 Yhdysvalloissa ” [116].

- Kohdassa 91 mainitussa FDA:n asiakirjassa luetellaan, mitkä erät oli jaettu mille tutkimuspaikoille 17. maaliskuuta 2021 mennessä. Samankaltaisessa asiakirjassa [117] luetellaan, mitkä erät oli toimitettu kullekin tutkimuspaikalle 19. marraskuuta 2020 mennessä. Kyseisessä asiakirjassa ainoa Process 2 -erä, joka on lueteltu, on EE8493 (huomautus: erää EJ0553 ei ole lueteltu). Näin ollen voidaan päätellä, että EE8493 oli ainoa prosessin 2 erä, joka oli jaettu kliinisten tutkimusten tutkimuspaikoille, kun prosessien 1 ja 2 vertailututkimus alkoi 19. lokakuuta 2020. Sitä toimitettiin tutkimuspaikkoihin 1133, 1135, 1146 ja 1170 sekä välivaiheen että 6 kuukauden potilaseräasiakirjojen mukaan.
- Niiden koehenkilöiden analyysi, jotka saivat ensimmäisen annoksensa 19. lokakuuta 2020 tai sen jälkeen [118], osoittaa, että näissä neljässä toimipisteessä oli yhteensä 252 koehenkilöä, jotka saivat rokotteen, ja 250 koehenkilöä, jotka saivat lumelääkettä [119]. Kaikki hoitohaaran 252 koehenkilöä olivat 16-55-vuotiaita. Tämä vastaa tutkimussuunnitelmassa esitettyä kuvausta suunnitellusta tutkimuksesta, jonka mukaan Process 2 -annoksia annettaisiin ”noin 250:lle 16-55-vuotiaalle osallistujalle”, kuten kohdassa 2 on yksityiskohtaisesti kuvattu. (Ks. liite A, jossa on luettelo 252 koehenkilöstä, jotka rekrytoitiin kyseisiin toimipaikkoihin kyseisenä ajanjaksona). Tämä analyysi voidaan vahvistaa tarkastelemalla silmämääräisesti BLA:n satunnaistamistiedostoa, jonka toimeksiantajat ovat toimittaneet FDA:lle [120].
- Erä EJ0553 toimitettiin toimipaikkaan 1007. Kohteessa 1007 19. lokakuuta 2020 jälkeen hoidon saaneilla 17:llä vastaanottajalla ei ole satunnaistamisnumeroita, jotka osoittavat, että heidät on sisällytetty Prosessien 1 ja 2 vertailututkimukseen, kuten kohdassa 100 on esitetty. Lisäksi vain 17 hoidettavaa henkilöä olisi voinut mahdollisesti saada annoksia erästä EJ0553, eikä noin 250:tä, kuten kohdassa 2 mainitussa pöytäkirjassa on suunniteltu. Näin ollen voimme päätellä, että nämä 17 koehenkilöä eivät kuuluneet suunniteltuun tutkimukseen, jossa verrattiin prosesseja 1 ja 2. Kun otetaan huomioon, että erä EJ0553 toimitettiin kolmelle muulle tutkimuspaikalle, joihin ei 14. marraskuuta 2020 jälkeen otettu uusia hoitohenkilöitä, on todennäköistä, että annokset tästä prosessin 2 erästä toimitettiin näille neljälle tutkimuspaikalle annettavaksi lumelääkehenkilöille, jotka vapautettiin sokkouttamatta ja jotka tarjoutuivat rokotettaviksi sen jälkeen, kun FDA oli myöntänyt kiireellisen käyttöluvan 11. joulukuuta 2020.
- Tässä analyysissä käytetyistä aineistoista ja asiakirjoista löytyy toinen keino vertailututkimukseen osallistuneiden koehenkilöiden tunnistamiseksi, jonka löysivät samat kirjoittajat kuin Michels et al. (mainittu kohdissa 71-79): koehenkilön satunnaistamisnumero [121]. Jokainen tutkimukseen osallistunut koehenkilö sijoittuu numeroiden 1081 ja 274318 väliin, lukuun ottamatta pientä 502 koehenkilön osajoukkoa, jonka satunnaistamisnumerot ovat välillä 400002 ja 401509. Näistä 252 on samoja hoitohenkilöitä, jotka on tunnistettu kohdassa 98 neljässä toimipaikassa, jotka saivat Process 2 -eriä ennen 19. marraskuuta 2020. Loput 250 ovat lumelääkettä saaneita, jotka ovat samoja kuin kohdassa 97 [122] yksilöidyt neljä toimipaikkaa. Tämä vahvistaa riippumattomasti kohdassa 80 esitetyn päätelmän, jonka mukaan nämä 252 hoitoa saanutta koehenkilöä, jotka olivat peräisin erän EE8493 saaneista toimipaikoista, olivat ainoat, jotka oli tarkoitettu prosessien 1 ja 2 väliseen vertailuun.
- Prosessin 1 ja prosessin 2 mukaisen koehenkilöiden värväyksen vertailu on esitetty viikkokaaviossa.
Todisteet siitä että Prosessien 1 ja 2 suunniteltua vertailua ei koskaan suoritettu
- Vastauksessaan FOI-pyyntöön 23/510, johon viitataan kohdassa 96 ja joka on tämän kertomuksen liitteenä, MHRA toteaa, että tutkimustuloksia odotettiin helmikuussa 2021 (sivu 2). Suunniteltu vertailu pöytäkirjasta kuitenkin ”poistettiin ja dokumentoitiin pöytäkirjamuutoksella 20 syyskuussa 2022, koska ’prosessin 2’ kautta valmistettuja rokotteita käytettiin laajasti.”. Näin ollen tätä prosessivertailua ei suoritettu osana virallista dokumentointia” (sivu 5). Ainakaan MHRA:n mielestä vertailututkimusta ei koskaan suoritettu.
Todisteet siitä, että nämä kaksi tuotetta eivät ole täysin samanlaisia: Prosessi 2 -valmisteen saajien keskuudessa esiintyy enemmän haittavaikutuksia
- Mallinnimme prosessin 2 vastaanottajana olemisen vaikutusta muihin muuttujiin verrattuna yhdysvaltalaisten, 55-vuotiaiden tai sitä nuorempien koehenkilöiden rekisteröimien haittavaikutusten määrään Poissonin regression avulla ja havaitsimme, että se lisää haittavaikutusten lukumäärää 264,33 prosentilla; sillä on erittäin merkittävä vaikutus haittavaikutuksiin (6,59 kertaa suurempi vaikutus kuin ”liitännäissairauksilla”), vaikkakin se on vähemmän merkittävä kuin sukupuolen tai liikalihavuuden vaikutus [123].
- Verrattaessa yksinomaan 95:tä ei-lihavuutta sairastavaa miespuolista vastaanottajaa Yhdysvalloissa prosessi 2 johtaa 211,77 prosentin lisäykseen, jonka vaikutus on 4,84 kertaa suurempi kuin komorbiditeetin vaikutus. Arviointi on samanlainen (214,49 % lisäys) negatiivisen binomiregression avulla.
Todisteet eroista lymfadenopatiassa prosessin 1 ja prosessin 2 erien välillä ja MHRA:n epätarkat lausunnot
- Lymfadenopatia on lääketieteellinen termi turvonneille imusolmukkeille. Kliinisen tutkimuksen (C4591001) kahden ensimmäisen rokoteannoksen ja kolmannen (tehosterokote) rokoteannoksen aiheuttaman lymfadenopatian esiintyvyydessä havaitut erot viittaavat prosessin 1 ja prosessin 2 rokotevalmisteen erilaisiin haittavaikutusprofiileihin. Syynä on se, että kliinisen tutkimuksen kaksi ensimmäistä annosta olivat valtaosin prosessilla 1 valmistettuja rokoteannoksia, kun taas useita kuukausia myöhemmin annetut tehosteannokset olisi valmistettu prosessilla 2 kaupallista toimitusta varten.
- Pfizerin/BioNTechin COVID-19 mRNA-rokotteen BNT162b2 väliaikaista toimituslupaa koskevassa ”MHRA’s Public Assessment Report for the Authorisation for Temporary Supply” -raportissa (MHRA:n julkinen arviointiraportti) kuvataan lymfadenopatian määrää kliinisen tutkimuksen C4591001124 alustavan raportin perusteella. Vaikka julkinen arviointiraportti (MHRA:n PAR) päivitettiin nuorten rokotusten osalta kesäkuussa 2021, kansilehdellä todetaan, että siinä ”esitetään yhteenveto alkuperäisestä arviosta hyväksynnän myöntämishetkellä joulukuussa 2020.”. Alkuperäisen raportin teksti säilyy ennallaan”.
- Kliinisen tutkimuksen C4591001 lymfadenopatian määrä on MHRA:n PAR:n sivulla 42 lueteltu 0,3 prosentiksi ja luokiteltu sivulla 50 ”harvinaiseksi”, joka on määritelty esiintyväksi yli 0,1 prosentissa tapauksista mutta alle 1 prosentissa tapauksista.
- MHRA:n kesäkuussa 2023 julkaistussa asiakirjassa ”Information for Healthcare Professionals on COVID-19 Vaccine Pfizer/BioNTech (Regulation 174)” lymfadenopatian määrä on esitetty taulukossa 1 [125]. Se on lueteltu harvinaiseksi. Mutta taulukon alaosassa olevassa huomautuksessa (a) todetaan: ”Lymfadenopatian esiintyvyys oli suurempi (5,2 % vs. 0,4 %) osallistujilla, jotka saivat tehosteannoksen (kolmas annos), verrattuna osallistujiin, jotka saivat kaksi annosta.”” Lymfadenopatian 5,2 %:n esiintymistiheys siirtäisi lymfadenopatian luokasta ”harvinainen” luokitukseen ”yleinen”. Se merkitsee yli 13-kertaista kasvua lymfadenopatian määrässä [126].
- Yksi mahdollinen selitys tälle lisääntymiselle on se, että tehosteannos saa aikaan voimakkaamman immuunireaktion, mikä johtaa lymfadenopatian lisääntymiseen. Tel Avivin yliopiston lääketieteellisen tiedekunnan israelilaistutkijoiden PET-CT-kuvauksia käyttäen suorittamissa huolellisissa ja erittäin tarkoissa lymfadenopatiaa koskevissa kuvantamistutkimuksissa todettiin kuitenkin, että ”minkä tahansa asteisen VAHL:n [rokotteeseen liittyvä hypermetabolinen lymfadenopatia] kokonaisesiintyvyys kolmannen COVID-19-rokoteannoksen jälkeen on pohjimmiltaan samankaltainen kuin mitä raportoitiin ensimmäisten ja toisten COVID-19-rokoteannosten jälkeen. Kolmannen annoksen jälkeisten VAHL-tapausten havaittiin kuitenkin olevan lyhyempikestoisia ja niiden tartuntaintensiteetti oli alhainen viiden ensimmäisen päivän kuluttua rokotuksesta ” [127]. Tämä tarkoittaa, että tehosterokotuksen jälkeinen lymfadenopatia ei ollut pahempi kuin kahden ensimmäisen rokoteannoksen jälkeen, vaan se oli joiltakin osin jopa lievempi.
- Israelilaisen tutkimuksen tulokset eivät ole yhdenmukaisia MHRA:n ilmoittaman lymfadenopatian 13-kertaisen lisääntymisen kanssa kahden ensimmäisen annoksen ja kolmannen annoksen välillä. Tätä israelilaista tutkimusta ei tehty osana kliinistä tutkimusta C4591001. Se perustui henkilöihin, jotka saivat kaupallisia annoksia, jotka toimitettiin Israeliin rokotteen käyttöönoton jälkeen, eli annoksia, jotka oli valmistettu prosessilla 2.
- Tämän perusteella voidaan erittäin suurella varmuudella päätellä, että MHRA:n ilmoittama lymfadenopatian lisääntyminen johtuu siirtymisestä kliinisessä tutkimuksessa käytetyistä prosessin 1 annoksista prosessin 2 annoksiin, joita käytettiin myöhemmin tehosteannoksina.
- Vaikka lymfadenopatian 5,2 prosentin osuuden lähdettä ei ole ilmoitettu, kun otetaan huomioon ajankohta, jolloin tehosteannokset annettiin ensimmäisen kerran vuoden 2021 jälkipuoliskolla, niiden on täytynyt olla peräisin prosessia 2 käyttäen annetuista tehosteannoksista. Lymfadenopatian lisääntynyttä määrää tehosteannoksissa tukee myös Pfizer/BioNTechin kliininen tutkimus C4591031, joka koski ensimmäistä tehosteannosta (kolmas annos) ja jossa lymfadenopatian osuus oli 2,7 % [128]. Tämä merkitsee yli kuusinkertaista kasvua annoksiin 1 ja 2 verrattuna, eikä se myöskään ole yhdenmukainen edellä mainitun israelilaisen tutkimuksen tuloksen kanssa (ks. viite 12), jonka mukaan lymfadenopatian määrässä ei ole eroa ensimmäisen tehosteannoksen ja aikaisempien annosten välillä.
Katkaisupäivät eivät olleet “tietojen katkaisupäiviä”
- Perinteisissä tutkimuksissa on rajapyykki, joka vastaa tutkimuksen kronologista päättymispäivää, mutta tässä tapauksessa tutkimus jatkui sekä EU:n myyntiluvan että BLA-hakemuksen jättämisen jälkeen. Käytännössä, vaikka BLA-aineistossa esitettiin asiakirjoja, joiden mukaan tutkimuksen päättymispäivä oli 13. maaliskuuta 2021, CRF-tiedotteita muokattiin aina 1. huhtikuuta 2021 asti, kuten minkä tahansa CRF-tiedoston silmämääräinen tarkastelu osoittaa — ks. esim. kohta 65. Tämä tekee BLA-hakemuksen jäljentämisen — kuten ilmoitettujen COVID-tapausten tarkan jäljentämisen — lähes mahdottomaksi ilman täydellistä pääsyä kirjausketjuun. Valtaosa ”COVID-oireiksi uudelleen kelpuutetuista” haittavaikutuksista liittyy näihin ”viime hetken muokkauksiin”. Esimerkkinä voidaan mainita vain muutamia 1028 CRF-tiedostosta löytyviä tietojen rajaamiseen liittyviä epäselvyyksiä:
- 12231058 [129] — 2. ja 3. maaliskuuta 2021 ilmenneet väsymystä ja pistoskohdan kipua koskevat haittavaikutukset kirjattiin 23. maaliskuuta 2021, ja ne ovat tietokannassa [130].

- 12261769 [131] — Koehenkilöllä on COVID-käynti 18. maaliskuuta 2021, joka on merkitty 19. maaliskuuta 2021 ja jota ei ole tietokannassa.
- 12312420 [132] — COVID-käynti A 12.3.-15.3.2021, merkitty 16.3.2021, ja COVID-käynti B, 26.3. – jatkuva, merkitty 29.3.2021, jossa positiivinen paikallinen pyyhkäisynäyte sivulla 235, eivät molemmat ole tietokannassa.
- 12313610 [133] — 19. helmikuuta 2021. tapahtunut eteislepatuksen SAE kirjattiin 20. maaliskuuta 2021, kun koepaikka oli lähettänyt alkuperäisen turvallisuustietokannan 19. maaliskuuta 2021, sivu 181, ja se on tietokannassa.

Lääketieteellisen historian porsaanreiän hyväksikäyttö
- Tutkimuspöytäkirjassa [134] määriteltiin merkittäviä porsaanreikiä haittatapahtumien kirjaamisessa, mikä käytännössä tarkoitti sitä, että jo olemassa olevia sairauksia tai koehenkilön sairaushistoriaan sisältyviä sairauksia ei kirjattaisi sen mukaan, miten päätutkija arvioi sairauden ”liittyvän luonteeseen”.

- Tämä pöytäkirjassa oleva porsaanreikä, jonka täydellinen kuvaaminen on työläs työ, joka ei ole tämän mietinnön aiheena, on mahdollistanut huomattavan ”olosuhteiden huonontumisen” harhaanjohtamisen. Esimerkiksi koehenkilö 10791044 [135] näkee ”nivelrikon pahenevan”, minkä seurauksena hänen molemmat polvensa vaihdettiin, tai 11171146 aortan aneurysman poistuvan AE-lokista tutkimuslääkärin arvion perusteella. [136]

Todisteet siitä, että nämä kaksi tuotetta eivät ole täysin samanlaisia: markkinoille tulon jälkeisissä tutkimuksissa todettu kohonnut kuukautisvuotojen määrä
- Myöhemmissä tutkimuksissa todettiin, että kuukautisvuotoa esiintyy paljon; esimerkiksi 12+% [137] Saudi-Arabiassa sijaitsevan yliopiston naisopiskelijoita ja henkilökuntaa koskevassa tutkimuksessa. Al Kadrin tekemässä meta-analyysissä [138] todettiin, että yhdistetty esiintyvyys oli 24,24 % (95 % CI: 12,8-35,6 %).
- Tutkimuksen aikana [139] haittavaikutuksina oli raportoitu vain neljä kuukautisvuototapausta – kaksi BNT162b2-hoitoa saaneista (0,065 % 3087:stä 16-39-vuotiaasta naisesta).
- Tarkasteltaessa sairaushistoriatietoja [140] löysimme 131 BNT:tä (1,77 %) 16-59-vuotiasta naishenkilöä, joilla oli aiemmin ollut menorragia – kaikkien kohdalla tapahtuman tilaksi oli asetettu ”VIIMEINEN TAPAHTUMA”. Osuus nousee 1,93 prosenttiin (143 tutkittavaa), jos mukaan otetaan muut tilat, joiden tutkimuslääkäri voi katsoa liittyvän menorragiaan (kohdun toimintahäiriöt, munasarjojen verenvuoto). Tämä on edelleen hyvin kaukana tutkimusten jälkeisistä luvuista, ja sen perusteella voidaan päätellä, että markkinoille saattamisen jälkeisissä tutkimuksissa todetut erittäin korkeat kuukautisvuototapausten luvut ovat toinen seuraus prosessiin 2 siirtymisestä.
Poikkeavuudet PCR-testauksessa
- Tutkimuksessa oli yhteensä 110 päivää 27. heinäkuuta 2020 – ensimmäisestä satunnaistamisesta – 14. marraskuuta 2020 tapahtuneeseen tietojen katkaisuun, joka oli viimeinen VRBPAC:lle toimitettuun tietoon ja New England Journal of Medicine -lehdessä julkaistuun Polackin artikkeliin sisältyvä tietopiste. Tänä ajanjaksona, ensimmäisen annoksen jälkeen, kirjattiin 448 positiivista PCR-testiä plasebo-haarassa ja 163 positiivista testiä BNT162b2-haarassa [141].
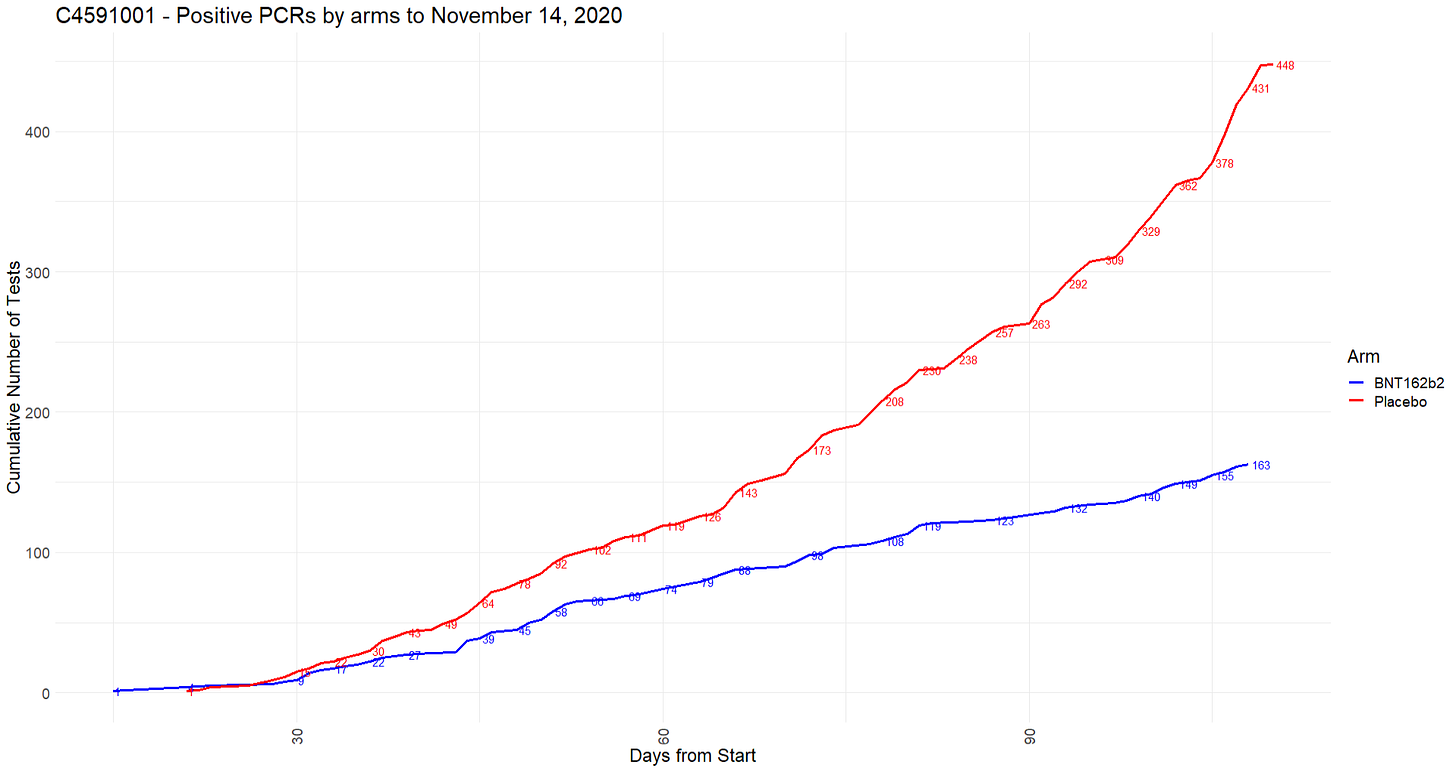
- Jos rajoitutaan protokollan mukaisesti testeihin, jotka on kirjattu 4 päivän kuluessa ilmenneillä oireilla, kokonaismäärä on 306 lumelääkettä ja 55 BNT162b2:ta. Oireettomuuden vuoksi hylätyn BNT162b2:n osuus (-66,3 %) verrattuna hylätyn lumelääkkeen määrään (-31,7 %) on luonnollisesti tilastollisesti erittäin merkittävä.

- Korostimme 69 kohdassa COVID-oireiden uudelleenmäärittelyn vaikutusta. Sen vuoksi on hyödyllistä tehdä samanlainen ”oireanalyysi”, jossa otetaan huomioon kirjatut COVID-oireet riippumatta kliinisen tutkimuksen henkilökunnan ylläpitämästä tietokokonaisuudesta. Tämä näkökulma nostaa kokonaismäärät 70 oireiseen BNT162b2:een, joilla on positiivinen PCR (+15), 316:een Placeboa (+10) vastaan, eikä selitä epätasapainoa. Oireisten PCR-testien kertyminen kussakin haarassa on esitetty seuraavassa kaaviossa.
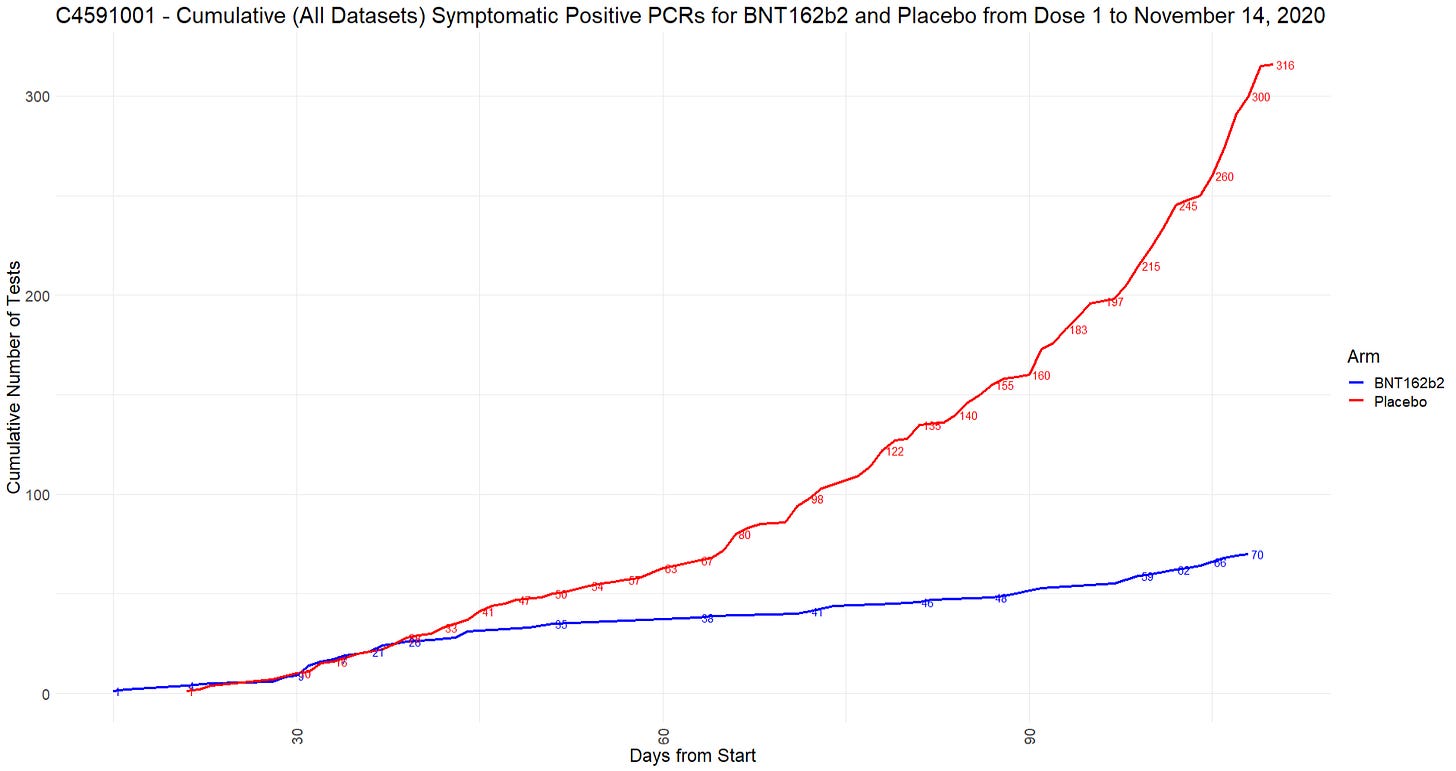
- Analysoimme maittain [142] Yhdysvaltojen ja Argentiinan osalta niiden henkilöiden prosenttiosuuden, jotka ilmoittivat oireistaan ja joiden tuloksena tehtiin keskitetty PCR-testi 4 päivän kuluessa protokollan mukaisesti. Tasoitimme renderöinnin 3 päivän liukuvalla keskiarvolla. Seuraavasta kaaviosta käy ilmi, että Yhdysvalloissa kutakin ilmoitettua oireiden aaltoa seuraa merkittävä lasku molempien testauksessa. Vaikka on mahdollista, että testejä on ollut liian vähän suurten COVID-aaltojen aikana, on myös mahdollista, että testien manipulointia, kuten oireiden kirjaamisen lykkäämistä tai muita testien lieventämistapoja, on esiintynyt näiden jyrkkien testimäärän laskujen aikana, koska siitä ei ole riittävää dokumentaatiota. Tämä ei missään tapauksessa ole sellainen testausmalli, jota voisimme odottaa tutkimuksessa, jonka tavoitteena on tuottaa luotettavia tuloksia.
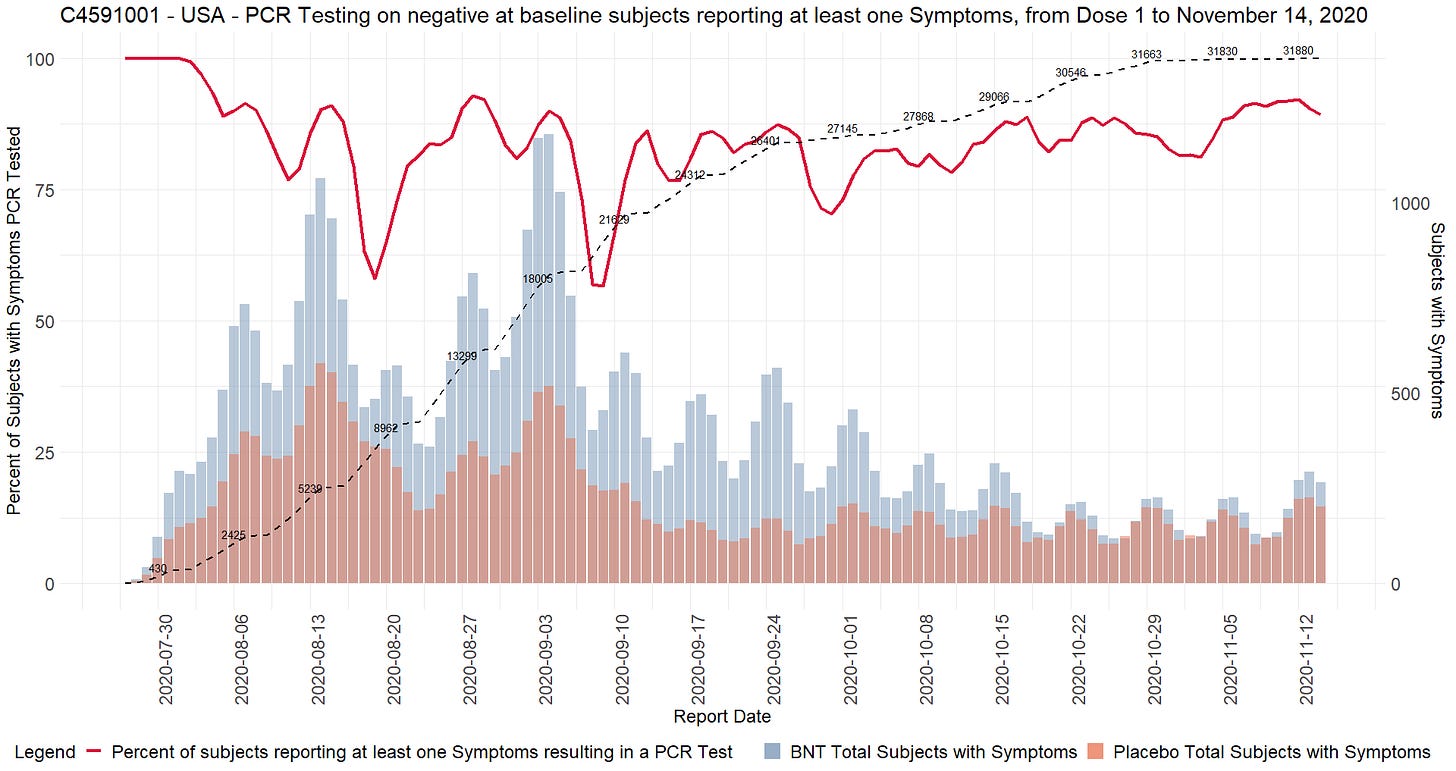
- Sama havaittavissa oleva kuvio, eli testaustiheyden jyrkkä lasku voimakkaan oireiden raportoinnin jaksojen jälkeen, on nähtävissä – ja se tapahtuu myös Argentiinassa [143], kun raportoitujen oireiden määrä on vähäinen – mikä herättää lisäkysymyksiä tapahtumista, jotka vaikuttivat oireista raportoivien koehenkilöiden testaamiseen.
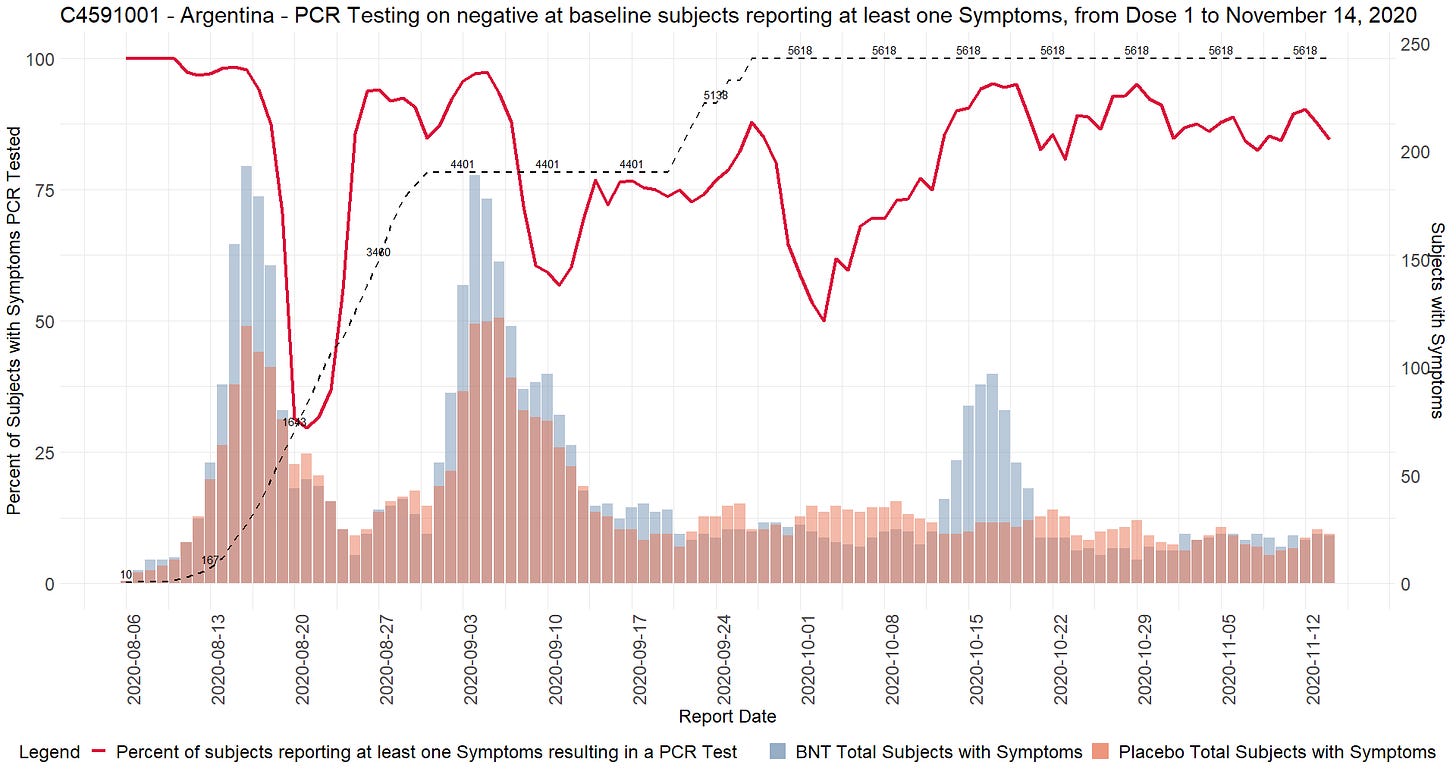
Koehenkilöiden COVID-käyntien PCR-testaukseen liittyvät poikkeavuudet
- Vaiheen 3 satunnaistetut koehenkilöt tekivät yhteensä 10 219 ”oireenmukaista käyntiä” – kukin ”oireenmukainen käynti” vastaa oireiden perusteella epäiltyä COVID-tautia, mutta voi aiheuttaa useita fyysisiä käyntejä koehenkilön toimipaikassa useiden päivien välein [144].
- Protokollaa noudattaen oireenmukaisten käyntien aikana otetut näytteet oli tarkoitus testata paikallisesti ja ”keskitetysti” Pfizerin Pearl Riverin laboratoriossa New Yorkissa, Yhdysvalloissa. Keskuslaboratoriotestit olivat suositeltavin menetelmä COVID-tapauksen vahvistamiseksi [145], vaikka protokollan vaihteluista riippuen voitiin käyttää FDA:n hyväksymiä paikallisia testejä [146]. Keskustestejä kirjattiin yhteensä 9474 ja paikallisia testejä 5489 kappaletta 13. maaliskuuta 2021 olevaan päättymispäivään mennessä.
- BNT162b2-ryhmään kuuluvien henkilöiden 4421 oireenmukaisesta käynnistä 87,2 % johti PCR-testien lähettämiseen keskuslaboratorioon, kun taas plaseboryhmään kuuluvien henkilöiden 5798 käynnistä 88,3 %. Tämä pieni ero ei ollut merkittävä.
- Sitä vastoin samana ajankohtana BNT162b2-ryhmän 4421 oireenmukaisesta käynnistä vain 43,5 % oli johtanut paikalliseen PCR-testaukseen, kun taas lumelääkeryhmän 5798 käynnistä 50,8 % oli johtanut paikalliseen PCR-testaukseen. Tämä ero on erittäin merkittävä, ja se osoittaa, että tietyissä paikoissa esiintyi merkittävä ero ryhmien välisessä hoidossa vastuullisten ryhmien toimesta.

- On myös tärkeää tarkkailla PCR-testejä varten tehtyjen koehenkilöiden hoitoa oireenmukaisten käyntien yhteydessä kiireellisen käyttöluvan (EUA) päättyessä Yhdysvalloissa 14. marraskuuta 2020. Tähän päivämäärään mennessä oli kirjattu 5415 oireista käyntiä. Vain 65,1 % BNT162b2- ja 65,5 %:lla lumelääkepotilaista oireenmukaiset käynnit olivat johtaneet keskitettyyn testaukseen.
- Vaikka ero paikallisten testien käsittelyssä on tilastollisesti vähemmän merkitsevä, se on edelleen olemassa. Tätä eroa, joka oli ilmeinen jo ennen kiireellisen myyntiluvan saamista, ei ole vielä selitetty.

- Analysoitaessa oireenmukaisia käyntejä, jotka johtivat keskitettyihin PCR-testeihin protokollaikkunan sisällä [147], määräajassa tehtyjen testien määrä laskee 54,2 prosenttiin BNT162b2:n osalta ja 56,2 prosenttiin Placebon osalta. Määräajan kuluessa tehtyjen paikallisten testien osuus vähenee myös, mutta ryhmien välillä on edelleen merkittävä ero hoidon suhteen: BNT162b2:lla tehtiin 29,2 prosenttia testeistä ja Placebolla 33,3 prosenttia (p-arvo 8,103e-06).
Paikallisten testien analyysi koepaikoittain osoittaa, että sokeisiin kohdistuvat rikkomukset sijaitsevat Yhdysvalloissa
- Palatakseni 127 kohdassa esitettyyn näkökulmaan (13. maaliskuuta 2021 COVID-käynnit – toisin sanoen BLA-tiedot analysoitiin), voimme keskittyä näihin poikkeavuuksiin testauspaikkakohtaisesti epänormaalien paikkojen tunnistamiseksi [148]. Suoritimme Fisherin tarkan testin koehenkilöille, joissa oli yhteensä vähintään 50 oireenmukaista käyntiä, jotta tunnistimme merkittävästi epätasapainoiset koehenkilöt — BNT162b2-ryhmän testaus oli systemaattisesti liian vähäistä verrattuna lumelääkeryhmään.
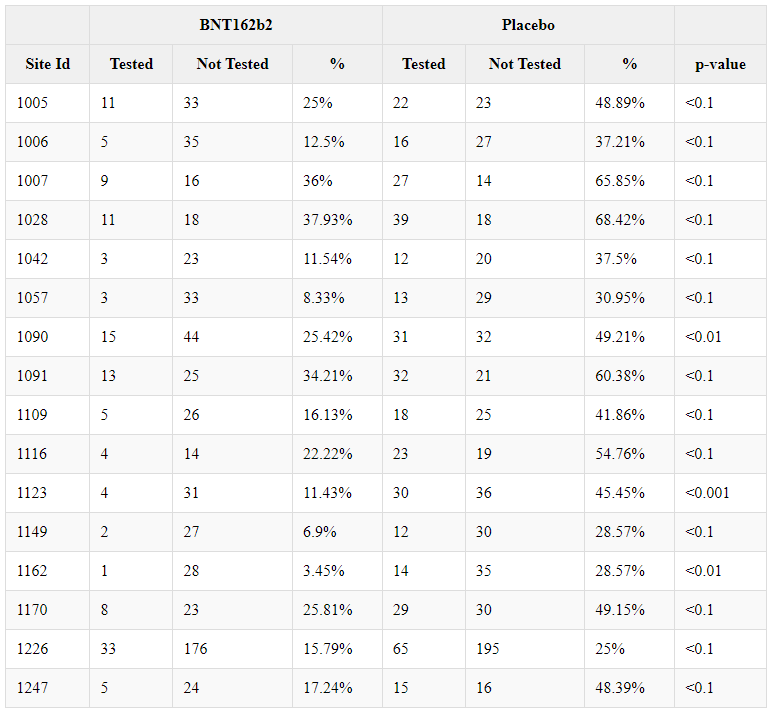
- Arvioidaksemme, voisivatko harvinaisemmat, vaihtelevat tai vakavat oireet selittää kuilun, mittasimme t-testillä (t = -4,729, p-arvo = 2,451e-06) koehenkilöiden ilmoittamien oireiden ja käyntien välisen eron näillä koepaikoilla. Koehenkilöiden käynneillään ilmoittamien oireiden keskiarvo oli 2,49 BNT:llä ja 2,89 Placebolla, mikä osoittaa, että BNT-koehenkilöt ilmoittivat huomattavasti vähemmän oireita kuin Placebo.
- Kun otetaan kuitenkin huomioon COVID-käynneistä johtuvien oireiden kyseenalainen luokittelu haittavaikutuksiksi, jota korostimme Augusto Roux’n todistajanlausunnon 46 kohdassa, ja ilmiön laaja-alaisuus, joka käy ilmi kohdista 61-66, on tarpeen huomata, että tämä vaikutus kääntyy päinvastaiseksi, jos tarkastelemme COVIDin kaltaisia oireita, jotka on raportoitu kaikissa tietokokonaisuuksissa. Seuraavassa kaaviossa esitetään niiden oireiden prosenttiosuus, jotka koehenkilöt ilmoittivat 7 päivän liukuvalla keskiarvolla molemmissa haaroissa ja jotka luokiteltiin COVID-oireiksi ja joihin liittyi COVID-käynti asianmukaisessa tietokokonaisuudessa. Se osoittaa, että BNT:n raportoimien oireiden osuus, jotka päättyivät oireenmukaiseen käyntiin, pysyi johdonmukaisesti alhaisempana aina EUA:n ja sokkoutuksen purkamiseen asti.
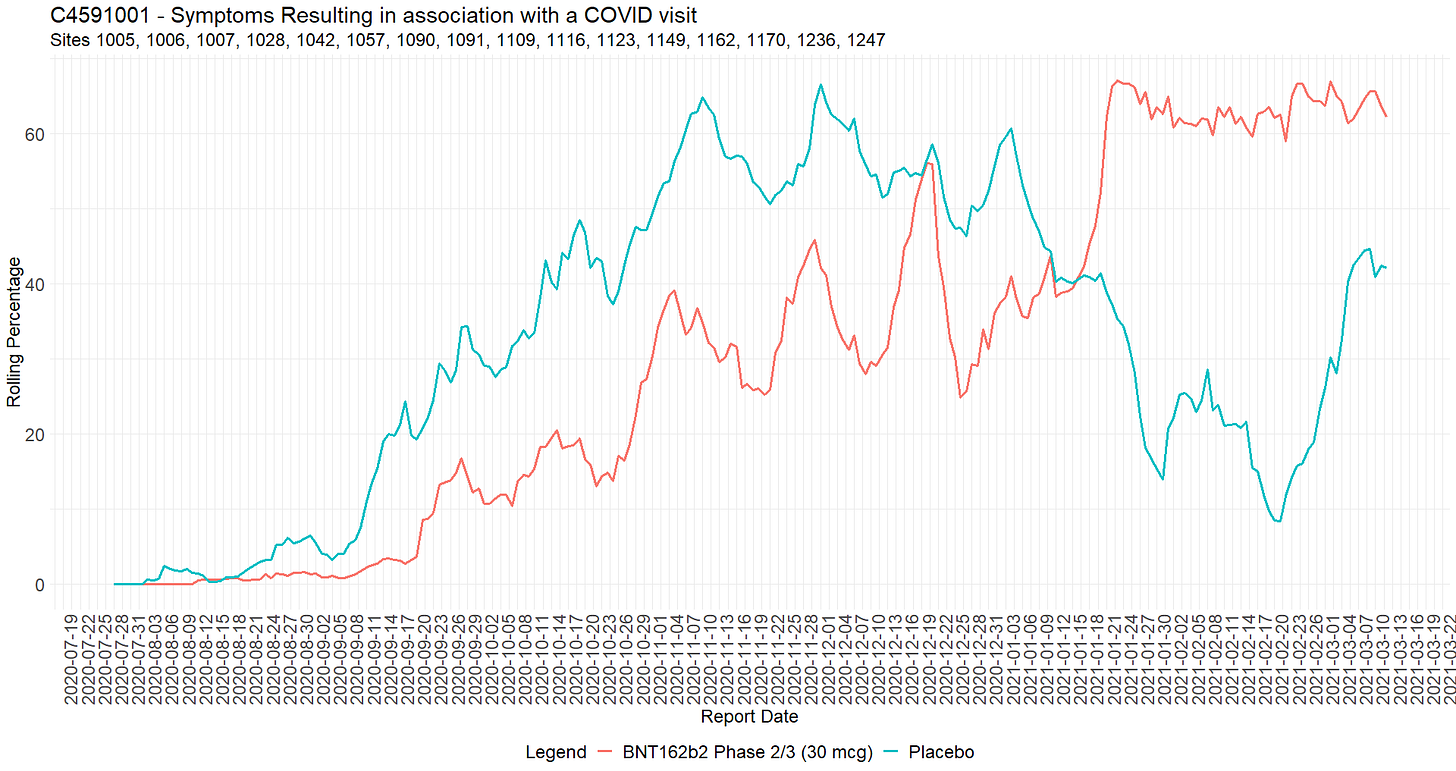
Yhteenveto tärkeimmistä poikkeamista tutkimuspaikkojen mittakaavassa
Merkittävimmät poikkeamat tutkimuspaikan mittakaavassa voidaan luokitella sokeisiin vaikuttaviin poikkeamiin:
- havaintopoikkeamat, kohta 33
- PCR-asteiden poikkeavuudet, kohta 131
ja ne, joissa on vakavia epäilyjä siitä, että henkilöitä on saatettu poistaa rekistereistä:
- ilmoitettujen satunnaistamisnumeroiden poikkeavuudet, kohta 25
- poikkeavuudet koehenkilöiden tunnistenumeroissa, kohta 48.
Seuraavissa taulukoissa esitetään yhteenveto kohteista, joihin on kohdistunut vaikutuksia; vain 17 kohdetta 153:sta luetellusta kohteesta on ”säästynyt” suurilta poikkeamilta.
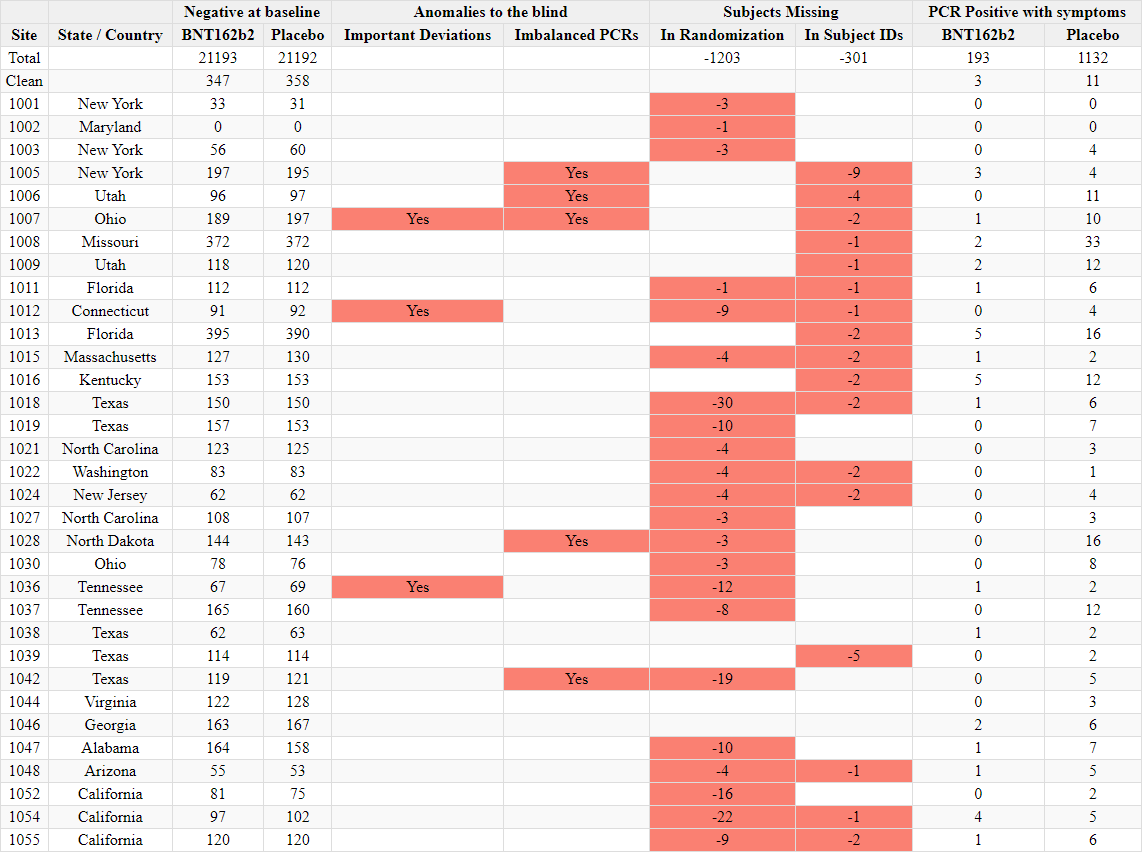
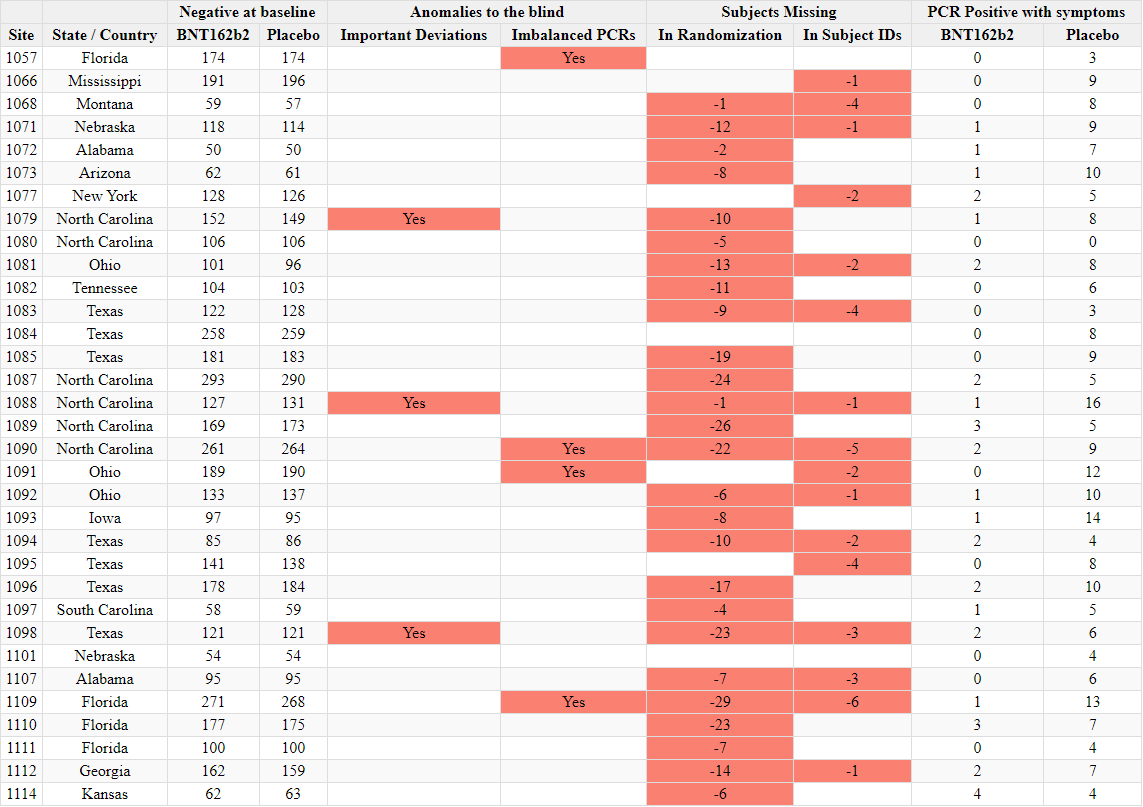
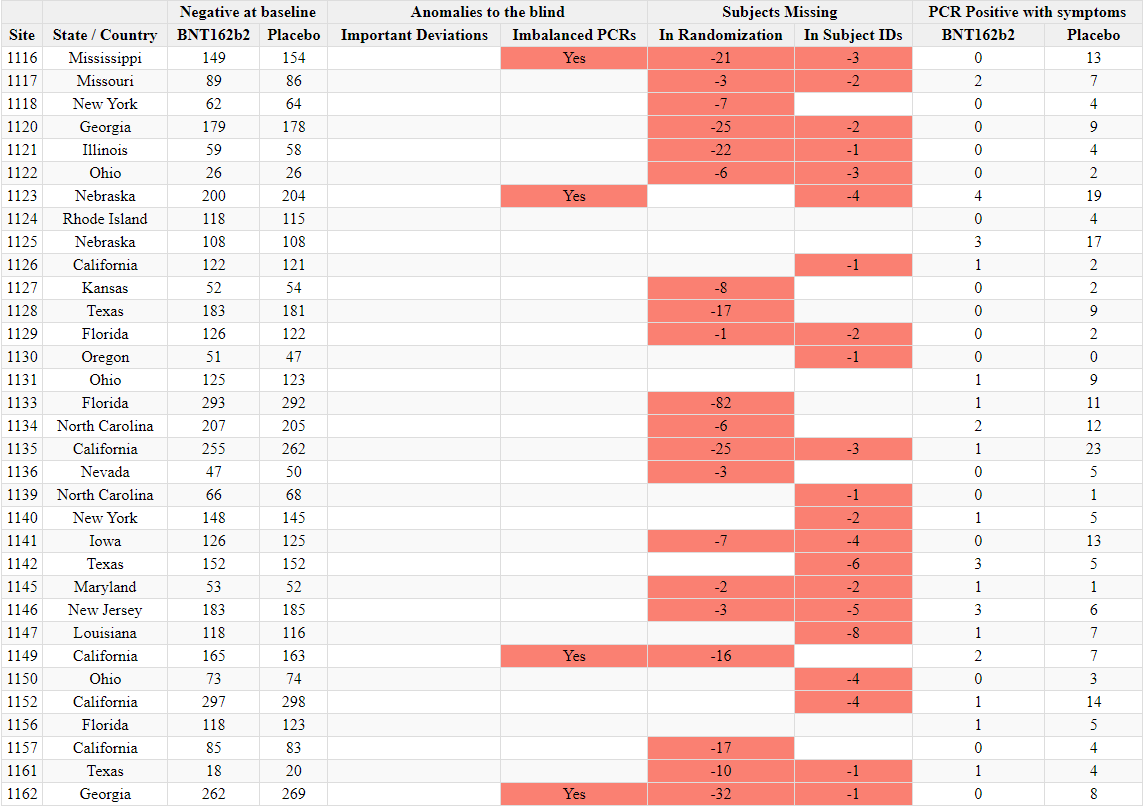
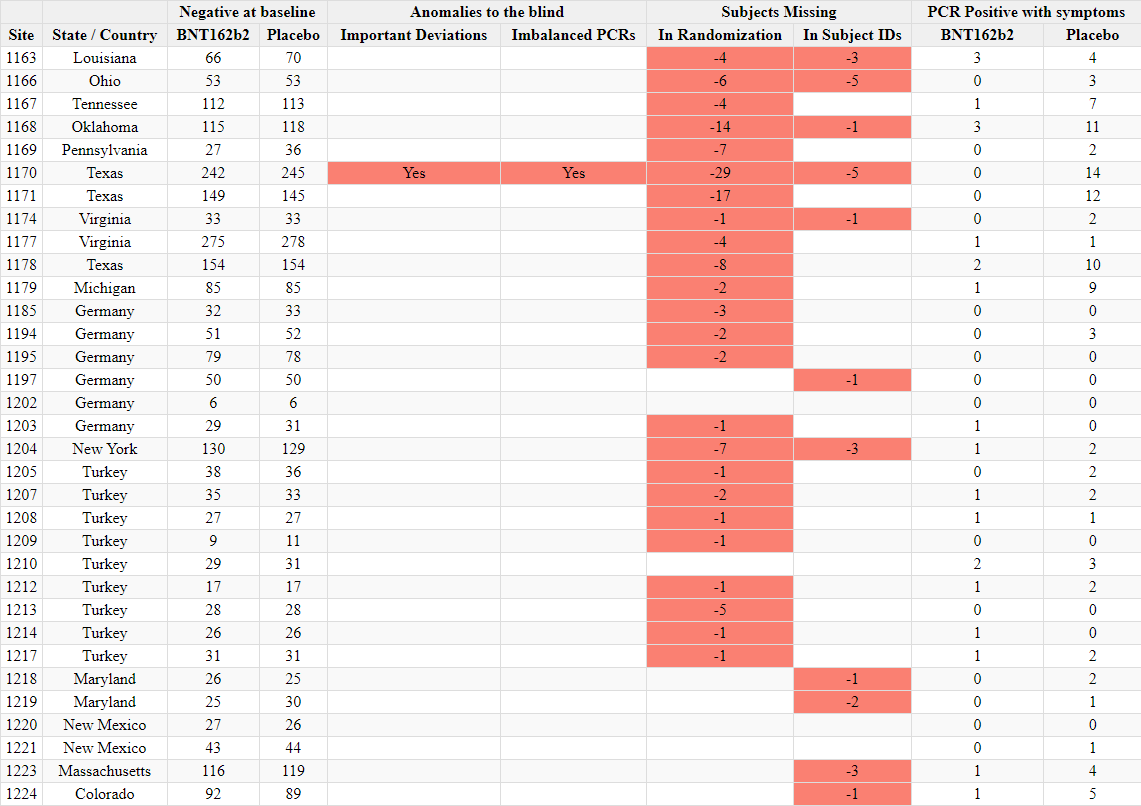
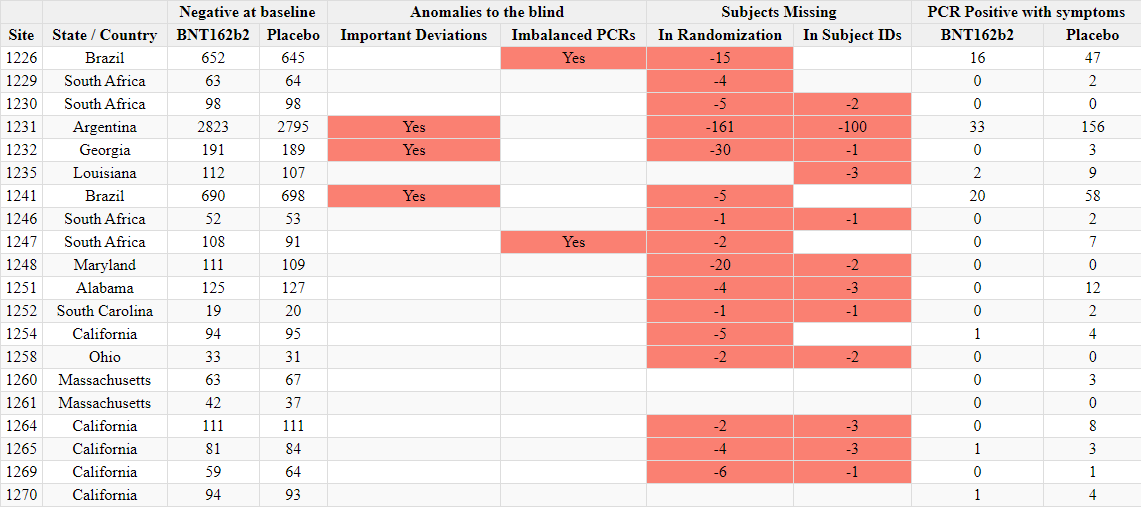
Lähdeviitteet
FDA.gov – Ramachandra Naik, Ph.D et al. – Emergency Use Authorization (EUA) for an Unapproved Product Review Memorandum – https://www.fda.gov/media/144416/download
STATNews.com – Peter Doshi and Matthew Herder – Did the FDA understaff its review of the Pfizer/BioNTech vaccine? – https://www.statnews.com/2020/12/17/did-the-fda-understaff-its-review-of-the-pfizer-biontech-vaccine
PHMPT.org – UNITED STATES DISTRICT COURT FOR THE NORTHERN DISTRICT OF TEXAS FORT WORTH DIVISION – https://phmpt.org/wp-content/uploads/2022/01/ORDER_2022_01_06.pdf
PHMPT.org – Public Health and Medical Professionals for Transparency –
R-4.4.0 for Windows – https://cran.r-project.org/bin/windows/base
R Script – download_full_prod.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/download_full_prod.R
R Script – extract_full_prod.R –
https://github.com/OpenVaet/pfizer_docs_R/blob/main/extract_full_prod.R
PHMPT.org – Pfizer 16+ Documents – https://phmpt.org/pfizer-16-plus-documents
pfizer.com – Pfizer and BioNTech to Submit Emergency Use Authorization Request Today to the U.S. FDA for COVID-19 Vaccine – https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine
FDA.gov – Susan Wollersheim, MD and Ann Schwartz, MD – BLA Clinical Review Memorandum – https://www.fda.gov/media/152256/download
R Script – extract_full_prod.R – screening_dates_range.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/screening_dates_range.R
PHMPT.org – Clinical Study Data Reviewer’s Guide – https://phmpt.org/wp-content/uploads/2022/05/125742_S1_M5_c4591001-S-csdrg.pdf, Page 24
PHMPT.org – 5.2-listing-of-clinical-sites-and-cvs-pages-1-41.pdf – https://phmpt.org/wp-content/uploads/2021/11/5.2-listing-of-clinical-sites-and-cvs-pages-1-41.pdf
R Script – screenings_by_weeks.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/screenings_by_weeks.R
Documentation – trial_site_data.json – https://github.com/OpenVaet/pfizer_docs_R/blob/main/trial_site_data.json
R Script – subjects_by_arms_and_sites.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/subjects_by_arms_and_sites.R
R Script – generate_screening_map.R, Scale: 1 subject / 100,000km² – https://github.com/OpenVaet/pfizer_docs_R/blob/main/generate_screening_map.R
PHMPT.org – C4591001 Investigational BNT162 Vaccine Program PF-07302048 – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-interim-mth6-oversight-committees.pdf, Page 42
FDA.gov – Susan Wollersheim, MD and Ann Schwartz, MD – BLA Clinical Review Memorandum – https://www.fda.gov/media/152256/download, Page 5
The New England Journal of Medicine – Edward E. Walsh, M.D et al. – Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates – https://www.nejm.org/doi/10.1056/NEJMoa2027906
Nature – Mark J. Mulligan et al., Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults – https://www.nature.com/articles/s41586-020-2639-4
R Script – screening_dates_range_phase1.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/screening_dates_range_phase1.R
PHMPT.org – Protocol C4591001 Protocol Amendment 9, 29 October 2020 – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, Page 87
PHMPT.org – Statistical Analysis Plan – https://phmpt.org/wp-content/uploads/2022/07/125742_S1_M5_5351_c4591001-fa-interim-sap.pdf, Pages 37 & 38
R Script – subjects_by_arms_and_sites_phase1.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/subjects_by_arms_and_sites_phase1.R
R Script – generate_screening_map_phase1.R, Scale: 1 subject / 100,000km² – https://github.com/OpenVaet/pfizer_docs_R/blob/main/generate_screening_map_phase1.R
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf, Pages 1974, 1782, 1695, 32
PHMPT.org – 125742_S1_M5_5351_c4591001-fa-interim-iec-irb-consent-form.pdf, CONSENT TO TAKE PART IN STUDY – https://phmpt.org/wp-content/uploads/2022/04/125742_S1_M5_5351_c4591001-fa-interim-iec-irb-consent-form.pdf, Page 87
R Script – phase_1_adva.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/phase_1_adva.R
The New England Journal of Medicine – Edward E. Walsh, M.D et al. – https://www.nejm.org/doi/pdf/10.1056/NEJMoa2027906 – Page 10
Documentation – phase_1_different_adva_results.csv – https://github.com/OpenVaet/pfizer_docs_R/blob/main/phase_1_different_adva_results.csv
PHMPT.org – Analysis Data Reviewer Guide, 125742_S1_M5_c4591001-A-adrg.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_c4591001-A-adrg.pdf, Page 33
PHMPT.org – 2.7.1 Summary of Biopharmaceutic Studies and Associated Analytical Methods https://phmpt.org/wp-content/uploads/2022/06/125742_S1_M2_summary-biopharm.pdf, Page 3
PHMPT.org – Qualification of the SARS-CoV-2 mNeonGreen Virus Microneutralization Assay https://phmpt.org/wp-content/uploads/2023/04/125742_S1_M5_5314_vr-mqr-10214.pdf
PHMPT.org – Method Validation of the SARS-CoV-2 mNeonGreen Virus Microneutralization Assay https://phmpt.org/wp-content/uploads/2023/04/125742_S1_M5_5314_vr-mvr-10083.pdf
PHMPT.org – 125742_S1_M5_5351_c4591001-fa-interim-iec-irb-consent-form.pdf, CONSENT TO TAKE PART IN STUDY – https://phmpt.org/wp-content/uploads/2022/04/125742_S1_M5_5351_c4591001-fa-interim-iec-irb-consent-form.pdf, Page 67
PHMPT.org – 125742_S1_M5_5351_c4591001-fa-interim-investigators.pdf, 16.1.4.1 LIST OF INVESTIGATORS AND NUMBER OF SITES AND SUBJECTS BY THE COUNTRY – https://phmpt.org/wp-content/uploads/2023/10/125742_S1_M5_5351_c4591001-fa-interim-investigators.pdf
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-investigators.pdf, 16.1.4.1 LIST OF INVESTIGATORS AND NUMBER OF SITES AND SUBJECTS BY THE COUNTRY – https://phmpt.org/wp-content/uploads/2023/10/125742_S1_M5_5351_c4591001-interim-mth6-investigators.pdf
R Script – investigators_screening_rando.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/investigators_screening_rando.R
Documentation – offset_randomization_between_fa_m6.csv – https://github.com/OpenVaet/pfizer_docs_R/blob/main/offset_randomization_between_fa_m6.csv
PHMPT.org – Analysis Data Reviewer Guide, 125742_S1_M5_c4591001-A-adrg.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_c4591001-A-adrg.pdf, Page 20
FDA.gov – Susan Wollersheim, MD and Ann Schwartz, MD – BLA Clinical Review Memorandum – https://www.fda.gov/media/152256/download, Page 7
The New England Journal of Medicine – Stephen J. Thomas, M.D. et al. – Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine through 6 Months – https://www.nejm.org/doi/10.1056/NEJMoa2110345 – “Between July 27, 2020, and October 29, 2020, a total of 45,441 participants 16 years of age or older underwent screening, and 44,165 underwent randomization at 152 sites”.
R Script – reproduce_rando_march_13.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/reproduce_rando_march_13.R
Documentation – phase_3_randomized_pop_stats.csv – https://github.com/OpenVaet/pfizer_docs_R/blob/main/phase_3_randomized_pop_stats.csv
PHMPT.org – Protocol C4591001 Protocol Amendment 9, 29 October 2020 – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, Page 57
R Script – format_deviations.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/format_deviations.R
PHMPT.org – Protocol C4591001 Protocol Amendment 9, 29 October 2020 – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, Page 64
FDA.gov – Ramachandra Naik, Ph.D et al. – Emergency Use Authorization (EUA) for an Unapproved Product Review Memorandum – https://www.fda.gov/media/144416/download, Page 14
PHMPT.org – Analysis Data Reviewer Guide, 125742_S1_M5_c4591001-A-adrg.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_c4591001-A-adrg.pdf, Pages 66 & 67
PHMPT.org – 125742_S1_M5_CRF_c4591001-1016-10161289.pdf – https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1016-10161289.pdf, Page 270
Ema.europa.eu – ICH guideline for good clinical practice E6(R2) – Step 5 – https://www.ema.europa.eu/en/documents/scientific-guideline/ich-guideline-good-clinical-practice-e6r2-step-5_en.pdf, Section 4.11 – Safety Reporting, Section 4.9 – Records and Reports, Section 5.17 – Monitoring, Section 8 – Essential Documents for the Conduct of a Clinical Trial
PHMPT.org – 125742_S1_M5_CRF_c4591001-1231-12315632.pdf – https://phmpt.org/wp-content/uploads/2023/06/125742_S1_M5_CRF_c4591001-1231-12315632.pdf, Page 301 & 314
TheBMJ – Paul D Thacker – Covid-19: Researcher blows the whistle on data integrity issues in Pfizer’s vaccine trial – https://www.bmj.com/content/bmj/375/bmj.n2635.full.pdf
davidhealy.org – Dr David Healy – Disappeared in Argentina – https://davidhealy.org/disappeared-in-argentina
IOS Press – David Healy, Augusto Germán Roux, Brianne Dressen – The coverage of medical injuries in company trial informed consent forms – https://content.iospress.com/articles/international-journal-of-risk-and-safety-in-medicine/jrs220043
Dr Hector E. Carvallo, Dr David Healy – Affidavit to Augusto Roux’s procedure
R Script – subject_12312982_aes.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/subject_12312982_aes.R
R Script – verify_301.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/verify_301.R
PHMPT.org – Statistical Analysis Plan – https://phmpt.org/wp-content/uploads/2022/07/125742_S1_M5_5351_c4591001-fa-interim-sap.pdf, Pages 13 & 46
PHMPT.org – 125742_S1_M5_5351_c4591001-fa-interim-lab-measurements-sensitive.pdf, Table 16.2.8.2 – Listing of Subjects With First COVID-19 Occurrence From 7 Days After Dose 2 and Without Evidence of Infection Prior to 7 Days After Dose 2 – Evaluable Efficacy (7 Days) Population – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-lab-measurements-sensitive.pdf, Page 66 to 99
R Script – extract_official_EUA_cases.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/extract_official_EUA_cases.R
R Script – analyze_eua_official_cases.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/analyze_eua_official_cases.R
Youtube – Pfizer & The National Geographic – Mission Possible, Race for a Vaccine – https://youtu.be/jbZUZ9JYNBE, 00:30:13 to 00:31:17
Spectator, Australia – Jeyanthi Kunadhasan, MD – 170 patients that changed everything – https://www.spectator.com.au/2022/12/170-patients-that-changed-everything, archived at web.archive.org/web/20221208045723/https://www.spectator.com.au/2022/12/170-patients-that-changed-everything/
R Script – eua_cases_deviations.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/eua_cases_deviations.R
PHMPT.org – 125742_S1_M5_5351_c4591001-fa-interim-discontinued-patients.pdf, 16.2.1.4 Listing of Subjects Withdrawn From the Study – All Subjects – https://phmpt.org/wp-content/uploads/2022/06/125742_S1_M5_5351_c4591001-fa-interim-discontinued-patients.pdf, Page 78
Nature Communications – Antonio E. Muruato et al. – A high-throughput neutralizing antibody assay for COVID-19 diagnosis and vaccine evaluation – https://ncbi.nlm.nih.gov/pmc/articles/PMC7426916
MDPI – Ming Luo et al. – Nucleocapsid Structure of Negative Strand RNA Virus – https://www.mdpi.com/1999-4915/12/8/835
Oxford Academic – Michael D Swartz et al. – Antibody Duration After Infection From SARS-CoV-2 in the Texas Coronavirus Antibody Response Survey – https://academic.oup.com/jid/article/227/2/193/6581498
R Script – anayse_n_binding_pcr.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/anayse_n_binding_pcr.R
PHMPT.org – Annotated Study Book for Study Design: C4591001 – https://phmpt.org/wp-content/uploads/2022/05/125742_S1_M5_c4591001-S-acrf.pdf, Page 11
PHMPT.org – Clinical Study Data Reviewer’s Guide – https://phmpt.org/wp-content/uploads/2022/05/125742_S1_M5_c4591001-S-csdrg.pdf, Page 34
R Script – subjects_adverse_effects_deleted.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/subjects_adverse_effects_deleted.R
PHMPT.org – 125742_S1_M1_meeting-correspondence.pdf, 1.6.3 CORRESPONDENCE REGARDING MEETINGS – https://phmpt.org/wp-content/uploads/2023/10/125742_S1_M1_meeting-correspondence.pdf, Page 574
PHMPT.org – 125742_S1_M5_CRF_c4591001-1218-12181001.pdf – https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1218-12181001.pdf, Page 401
PHMPT.org – 125742_S1_M5_CRF_c4591001-1087-10871286.pdf – https://phmpt.org/wp-content/uploads/2023/08/125742_S1_M5_CRF_c4591001-1087-10871286.pdf
R Script – aes_between_d2_d3.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/aes_between_d2_d3.R
PHMPT.org – CRFs for site 1055.pdf – https://phmpt.org/wp-content/uploads/2021/12/CRFs-for-site-1055.pdf, Pages 1125 to 1403
R Script – aes_crfs_missing.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/aes_crfs_missing.R
PHMPT.org – 125742_S1_M5_CRF_c4591001-1140-11401282.pdf – https://phmpt.org/wp-content/uploads/2023/08/125742_S1_M5_CRF_c4591001-1140-11401282.pdf
PHMPT.org – 125742_S1_M5_CRF_c4591001-1241-12411347.pdf – https://phmpt.org/wp-content/uploads/2023/08/125742_S1_M5_CRF_c4591001-1241-12411347.pdf
Koehenkilöt, joiden CRF-tiedostossa ei ole AE:tä, mutta jotka kuitenkin esiintyvät ADAE:ssä: 10081603, 10371141, 10371214, 10771137, 10811102, 10851018, 10901492, 10961181, 10961355, 11071196, 11101164, 11101165, 11171079, 11261244, 11281241, 11281267, 11331317, 11341327, 11351257, 11471230, 11501153, 11561131, 12314335, 12321299, 12411269, 12411493, 12411829, 12411930, 12412055, 12511029, 12511031, 12511033, 12511072, 12511145, 44441035
Koehenkilöt, joiden AE:t puuttuvat CRF-tiedostosta, mutta esiintyvät ADAE:ssä: 10071441, 10081152, 10131229, 10131386, 10131718, 10161087, 10191021, 10191145, 10211081, 10211084, 10281083, 10281205, 10381050, 10441163, 10471012, 10551128, 10551139, 10551145, 10551182, 10791183, 10801013, 10811179, 10831050, 10831173, 10841219, 10841538, 10871266, 10901140, 10911213, 10911247, 10911297, 10931067, 10931128, 11071191, 11091036, 11091074, 11091164, 11091204, 11101236, 11311140, 11331537, 11401066, 11401244, 11401282, 11401285, 11411143, 11461181, 11461302, 11521053, 11521095, 11521316, 11561001, 11781257, 11951017, 11951023, 12261477, 12312660, 12315186, 12315579, 12411053, 12411117, 12411347, 12411410, 12411561, 12411568, 12412191, 12412218, 12511060, 12541109, 12541189, 12601018, 12601108, 44441422
ECFR.gov – 21 CFR 312.57 – https://www.ecfr.gov/current/title-21/chapter-I/subchapter-D/part-312/subpart-D/section-312.57
Ema.europa.eu – ICH guideline for good clinical practice E6(R2) – Step 5 – https://www.ema.europa.eu/en/documents/scientific-guideline/ich-guideline-good-clinical-practice-e6r2-step-5_en.pdf
Documentation – adae_to_covid_symptoms.csv – https://github.com/OpenVaet/pfizer_docs_R/blob/main/adae_to_covid_symptoms.csv
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf, Page 97
R Script – aes_and_symptoms_by_subjects.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/aes_and_symptoms_by_subjects.R
R Script – unblinding_by_arm_and_age_groups.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/unblinding_by_arm_and_age_groups.R
International Journal of Vaccine Theory, Practice, and Research – Corinne Michels et al. – Forensic analysis of the 38 subject deaths in the 6-Month Interim Report of the Pfizer/BioNTech BNT162b2 mRNA Vaccine Clinical Trial – https://ijvtpr.com/index.php/IJVTPR/article/view/86
Dr Jeyanthi Kunadhasan, MD (UKM), MMed (AnaesUM), FANZCA MMED (Monash), Open Letter to Dr Anthony Lawler, TGA’s Health Products Regulation Group – March 21, 2024
Professor Anthony Lawler – TGA’s Health Products Regulation Group, Letter to Dr Jeyanthi Kunadhasan – March 27, 2024
Dr Jeyanthi Kunadhasan, MD (UKM), MMed (AnaesUM), FANZCA MMED (Monash), Open Letter to Dr Anthony Lawler, TGA’s Health Products Regulation Group – May 17, 2024
The New England Journal of Medicine – Fernando P. Polack et al. – Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine – https://www.nejm.org/doi/full/10.1056/nejmoa2034577
Centers for Disease Control & Prevention – Underlying Cause of Death, 2018-2022, Single Race Request – https://wonder.cdc.gov/ucd-icd10-expanded.html, ”Year/Month: 2020; 2021”, ”Group By: State; Five-Year Age Groups; Year; Month”, ”Show Totals: Disabled”, ”Show Zero Values: False”, ”Show Suppressed: False”, ”Calculate Rates Per: 100,000”, ”Rate Options: Default intercensal populations for years 2001-2009 (except Infant Age Groups)”
Documentation – Underlying Cause of Death, 2018-2022, Single Race.txt – https://raw.githubusercontent.com/OpenVaet/pfizer_docs_R/main/us_mortality/Underlying%20Cause%20of%20Death%2C%202018-2022%2C%20Single%20Race.txt
Documentation – Single-Race Population Estimates 2020-2022.txt – https://github.com/OpenVaet/pfizer_docs_R/blob/main/us_mortality/Single-Race%20Population%20Estimates%202020-2022.txt
Centers for Disease Control & Prevention – Single-Race Population Estimates 2020-2022 Request – https://wonder.cdc.gov/single-race-v2022.html, ”Yearly July 1st Estimates: 2020; 2021”, ”Group By: State; Yearly July 1st Estimates; Age Group”, ”Show Totals: True”, ”Show Zero Values: False”
R Script – model_deaths_to_us_underlying_mortality.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/model_deaths_to_us_underlying_mortality.R
NEJM.org – Protocol – https://www.nejm.org/doi/suppl/10.1056/NEJMoa2034577/suppl_file/nejmoa2034577_protocol.pdf, Page 174
European Medicine Agency – Committee for Medicinal Products for Human Use (CHMP) – Product Assessment report (PAR) – https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf, Page 18
Pharmaceutical and Medical Products Agency – Pharmaceutical Evaluation Division, Pharmaceutical Safety and Environmental Health Bureau, Ministry of Health, Labour and Welfare – Report on the Deliberation Results – https://www.pmda.go.jp/files/000243206.pdf, Page 13
PHMPT.org – Protocol C4591001 Protocol Amendment 9, 29 October 2020 – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, Page 310
PHMPT.org – Protocol C4591001 Protocol Amendment 9, 29 October 2020 – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, Page 360
PHMPT.org – Protocol C4591001 Protocol Amendment 9, 29 October 2020 – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-fa-interim-protocol.pdf, Page 360
Australian TGA, FOI 2389 – Pfizer/BioNTech COVID-19 mRNA vaccine (BNT162, PF-07302048) TGA Pre-Submission Meeting – https://www.tga.gov.au/sites/default/files/foi-2389-03-1.pdf, Pages 21 to 23
Australian TGA, FOI 3659 – BNT162b2 (PF-07302048) Comparability Report for PPQ Drug Product Lots – https://www.tga.gov.au/sites/default/files/2022-08/foi-3659-04.pdf, Pages 4 & 5
Australian TGA, FOI 3659 – BNT162b2 (PF-07302048) Comparability Report for PPQ Drug Product Lots – https://www.tga.gov.au/sites/default/files/2022-08/foi-3659-04.pdf, Page 3
PHMPT.org – 125742_S2_M3_32p5_batch-analyses.pdf, BNT162b2 3.2.P.5.4. Batch Analyses – https://phmpt.org/wp-content/uploads/2023/11/125742_S2_M3_32p5_batch-analyses.pdf, Page 3
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-patient-batches.pdf – https://phmpt.org/wp-content/uploads/2022/06/125742_S1_M5_5351_c4591001-interim-mth6-patient-batches.pdf
Documentation – The Vaccine Adverse Event Reporting System (VAERS).txt – https://github.com/OpenVaet/pfizer_docs_R/blob/main/vaers/The%20Vaccine%20Adverse%20Event%20Reporting%20System%20(VAERS).txt
Centers for Disease Control & Prevention – VAERS – https://wonder.cdc.gov/vaers.html, VAERS Data Search, “Group by:Year Reported,Month Reported, Vaers Id”, “Vaccine Products: COVID19 (COVID19 VACCINE), COVID19-2 (COVID19-2)”, “Vaccine Manufacturer: Pfizer\BioNTech”, “Vaccine lot:EE8493, EJ0553”
Documentation – The Vaccine Adverse Event Reporting System (VAERS)_other_batches.txt – https://github.com/OpenVaet/pfizer_docs_R/blob/main/vaers/The%20Vaccine%20Adverse%20Event%20Reporting%20System%20(VAERS)_other_batches.txt
PHMPT.org – 125742_S1_M5_5351_c4591001-fa-interim-patient-batches.pdf – https://phmpt.org/wp-content/uploads/2022/06/125742_S1_M5_5351_c4591001-fa-interim-patient-batches.pdf
R Script – process_2_subjects_by_sites_and_date.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/process_2_subjects_by_sites_and_date.R
Documentation – process_2_recipients_by_dates_and_sites.csv – https://github.com/OpenVaet/pfizer_docs_R/blob/main/process_2_recipients_by_dates_and_sites.csv
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-randomization-sensitive.pdf, 16.1.7.1 Listing of Randomization Scheme and Actual Vaccine Received – All Subjects ≥16 Years of Age – https://phmpt.org/wp-content/uploads/2022/05/125742_S1_M5_5351_c4591001-interim-mth6-randomization-sensitive.pdf
R Script – process_2_subjects_by_randomization_numbers.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/process_2_subjects_by_randomization_numbers.R
R Script – compare_process_2_identification_methods.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/compare_process_2_identification_methods.R
R Script – model_process_2_aes.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/model_process_2_aes.R
MHRA’s Public Assessment Report for the Authorisation for Temporary Supply of Pfizer/BioNTech’s COVID-19 mRNA Vaccine BNT162b2 – https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/1112667/COVID-19_mRNA_Vaccine_BNT162b2__UKPAR___PFIZER_BIONTECH_ext_of_indication_11.6.2021.pdf
GOV.UK – ARCHIVE: Information for Healthcare Professionals on COVID-19 Vaccine Pfizer/BioNTech (Regulation 174) – https://www.gov.uk/government/publications/regulatory-approval-of-pfizer-biontech-vaccine-for-covid-19/information-for-healthcare-professionals-on-pfizerbiontech-covid-19-vaccine
Note that the PAR from December 2020 states a lymphadenopathy rate from doses 1 and 2 of 0.3% but the updated information for healthcare professionals cites a rate of 0.4%. The difference is because the original clinical trial had not finished recruiting participants when authorization was granted in December, 2020. The complete trial data put the rate at 0.4% instead of 0.3%.
European Journal of Nuclear Medicine and Molecular Imaging – Cohen, D., Hazut Krauthammer, S., Wolf, I. et al. – A sigh of relief: vaccine-associated hypermetabolic lymphadenopathy following the third COVID-19 vaccine dose is short in duration and uncommonly interferes with the interpretation of [18F]FDG PET-CT studies performed in oncologic patients. –
https://doi.org/10.1007/s00259-021-05579-7
The New England Journal of Medicine – Moreira ED Jr, Kitchin N, Xu X, et al. – Safety and efficacy of a third dose of BNT162b2 Covid-19 vaccine. –
https://www.nejm.org/doi/full/10.1056/NEJMoa2200674, Table 2
PHMPT.org – 125742_S1_M5_CRF_c4591001-1223-12231058.pdf – https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1223-12231058.pdf
R Script – aes_cutoff_anomalies.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/aes_cutoff_anomalies.R
PHMPT.org – 125742_S1_M5_CRF_c4591001-1226-12261769.pdf – https://phmpt.org/wp-content/uploads/2023/06/125742_S1_M5_CRF_c4591001-1226-12261769.pdf
PHMPT.org – 125742_S1_M5_CRF_c4591001-1231-12312420.pdf – https://phmpt.org/wp-content/uploads/2023/06/125742_S1_M5_CRF_c4591001-1231-12312420.pdf
PHMPT.org – 125742_S1_M5_CRF_c4591001-1231-12313610.pdf – https://phmpt.org/wp-content/uploads/2023/06/125742_S1_M5_CRF_c4591001-1231-12313610.pdf
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf, Page 206
PHMPT.org – 125742_S1_M5_CRF_c4591001-1079-10791044.pdf, https://phmpt.org/wp-content/uploads/2023/08/125742_S1_M5_CRF_c4591001-1079-10791044.pdf, Page 160
PHMPT.org – 125742_S1_M5_CRF_c4591001-1117-11171146.pdf, https://phmpt.org/wp-content/uploads/2023/05/125742_S1_M5_CRF_c4591001-1117-11171146.pdf, Page 178
R Script – inspect_menstrual_disorders_aes.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/inspect_menstrual_disorders_aes.R
MDPI, Medicina – Nahid Ibrahim Fallatah et al. – Menstrual Changes Following COVID-19 Vaccination: A Cross-Sectional Study – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10890281/
Journal of Infection and Public Health – Hanan M. Al Kadri et al. – COVID-19 vaccination and menstrual disorders among women: Findings from a meta-analysis study – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9979695
R Script – parse_medical_history.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/parse_medical_history.R
R Script – positive_pcrs_by_days_from_start.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/positive_pcrs_by_days_from_start.R
R Script – tests_on_symptoms.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/tests_on_symptoms.R
R Script – tests_on_symptoms_arg.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/tests_on_symptoms_arg.R
R Script – tests_on_symptomatic_visits.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/tests_on_symptomatic_visits.R
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf, Page 63
PHMPT.org – 125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf – https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M5_5351_c4591001-interim-mth6-protocol.pdf, Page 97
R Script – tests_on_symptomatic_visits_4_days.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/tests_on_symptomatic_visits_4_days.R
R Script – tests_on_symptomatic_visits_by_sites.R – https://github.com/OpenVaet/pfizer_docs_R/blob/main/tests_on_symptomatic_visits_by_sites.R
Artikkelin julkaissut openvaet.substack.com